
用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;…… |
下列对实验现象的解释或推测不合理的是( )
A.a、d处:2H2O+2e-=H2↑+2OH-
B.b处:2Cl--2e-=Cl2↑
C.根据实验一的原理,实验二中m处能析出铜
D.n处发生了反应:2H++2e-=H2 ↑
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. 第一电离能:X一定大于Y
B. 气态氢化物的稳定性:HmY大于HnX
C. 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D. X和Y形成化合物时,X显负价,Y显正价
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:下列说法中正确的是

A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
根据碘与氢气反应的热化学方程式下列判断正确的是

A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氢氧燃料电池工作时,H2在负极上失去电子
B.0.1mol·L-1Na2CO3溶液加热后,溶液的pH减小
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
利用如图所示装置进行以下实验,能得到相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2S | H2S溶液 | SO2具有还原性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3 | 溶液酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式,不正确的是( )
A.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
B.NH4Al(SO4)2溶液中加入少量的氢氧化钠溶液:Al3++3OH-==Al(OH)3↓
C.用惰性电极电解MgCl2溶液2H2O+2Cl- Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)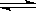 CaCO3(s)+Na2SO4(aq)
CaCO3(s)+Na2SO4(aq)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
从下列事实所得出的相应结论正确的为
实验事实 | 结论 | |
① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有酸性 |
② | 浓硫酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
③ | 取矢量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
A.②⑤ B.①② C.④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:选择题
电子计算器中所用纽扣式电池为银锌电池,其电极分别为 Ag2O和Zn,电解质溶液为 KOH溶液,电极反应为 Zn+2OH-2e-=Zn(OH)2, Ag2O+H2O+2e-=2Ag+2OH-,总反应式为 Ag2O+H2O +Zn = Zn(OH)2+2Ag。下列叙述不正确的是
A.电子由锌经外电路流向氧化银
B.该电池可实现化学能和电能的相互转化
C.锌是负极,氧化银是正极
D.工作时,负极区溶液 pH 减小,正极区 pH 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com