
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]()
![]() NH4ClO4,下列说法错误的是( )
NH4ClO4,下列说法错误的是( )
A.NH4ClO4属于离子化合物
B.溶解度:NaClO4>NH4ClO4
C.该流程中可循环利用的物质是NH4Cl
D.高氯酸铵中氯元素的化合价为+7价
科目:高中化学 来源: 题型:
【题目】2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生如下反应:2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.NO和O2的物质的量之比保持不变
D.每消耗1 molO2同时生成2 molNO
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度:
CH3OH(g),达平衡后测得各组分浓度:
物质 | CO | H2 | CH3OH |
浓度(mol/L) | 0.9 | 1.0 | 0.6 |
回答下列问题:
①混合气体的平均相对分子质量=_________________。
②平衡常数K=__________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正______v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)试解释碳酸氢钠水溶液显碱性的原因_____________________________。(用离子方程式和文字叙述解释)
(2)CuSO4的水溶液呈酸性的原因是:________(用离子方程式表示);实验室在配制CuSO4溶液时,需向CuSO4的溶液中加入少量硫酸,其目的是________。
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是________(填序号)。
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-)(填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为______。
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的Al2(SO4)3、较多的Cu2+和少量的Na+。从工业废水中回收金属铝和金属铜的工艺流程如下图所示(试剂X、Y、Z均过量)。
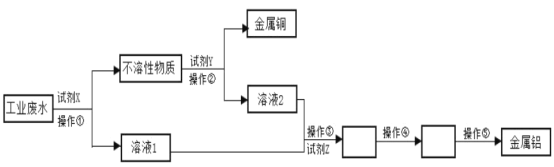
(1)试剂X为_______,加入试剂X发生的离子方程式是___________试剂Z为___________。
(2)操作②为____________(填实验分离方法)。
(3)溶液2中含有的溶质有__________(填化学式)。
(4)写出操作④的化学反应方程式____________。
(5)金属铜能与浓硫酸在加热的条件下发生反应,产生的气体为_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述不正确的是( )
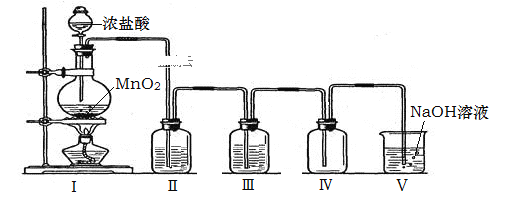
A.本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热
B.装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液
C.氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气
D.装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
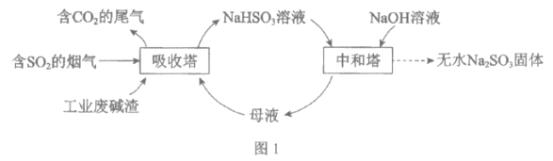
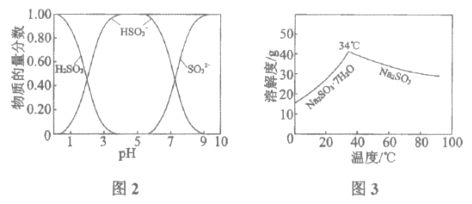
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com