
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:阅读理解
| 温度/℃、00w | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 投料方式 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 原料转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)恒容容积为VL的密闭容器中发生2NO2 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2 2NO2
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)恒容容积为VL的密闭容器中发生2NO2 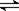 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2 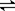 2NO2
2NO2
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
查看答案和解析>>
科目:高中化学 来源:2014届湖南省怀化市高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(16分)工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
|
温度/℃ |
250 |
300 |
350 |
|
K |
2.041 |
0.270 |
0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
投料方式 |
1molCO、 2molH2 |
1molCH3OH |
2molCH3OH |
|
|
平衡数据 |
C(CH3OH)/(mol/L) |
c1 |
c2 |
c3 |
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
原料转化率 |
α1 |
α2 |
α3 |
下列分析正确的是 。(填序号)
A.2c1 <c3 B.2 p1 <p3 C.|a|+|b|=90.8 D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源:2013届浙江瑞安中学高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)恒容容积为VL的密闭容器中发生2NO2 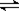 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
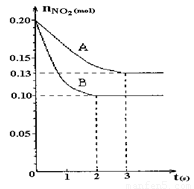
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是 。
A.有、无催化剂 B.温度不同 C.压强不同 D.体积不同
(2)写出该反应的化学平衡常数K的表达式: ,并比较K800℃ K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)= 。
(4)不能说明该反应已达到平衡状态的是 。
A.v正(NO2)=v逆(NO) B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(5)在如图所示的三个容积相同的三个容器①、②、③进行反应:2NO+O2 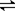 2NO2
2NO2
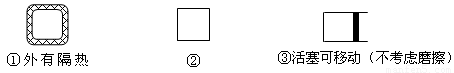
若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com