
分析 同温同体积时,压强之比等于物质的量之比,故n前:n后=2×105Pa:1.5×105Pa=4:3,n剩(O2)=$\frac{1.6g}{32g/mol}$=0.05mol,n(NO)=$\frac{12g}{30g/mol}$=0.4mol,设反应前有O2amol,NO的转化率为x,则反应NO0.4xmol,据方程式2NO+O2=2NO2,则反应O20.2xmol,故0.2x+0.05=a①,反应前气体总物质的量为n前=0.4+a,反应后气体总物质的量为n后=0.4+a-0.2x,又因为n前:n后=4:3,故.(4+a):(0.4+a-0.2x)=4:3②,联立①②得x=0.75,a=0.2,故一氧化氮的转化率为$\frac{0.4×0.75}{0.4}×100%$=75%,据此进行分析.
解答 解:同温同体积时,压强之比等于物质的量之比,故n前:n后=2×105Pa:1.5×105Pa=4:3,n剩(O2)=$\frac{1.6g}{32g/mol}$=0.05mol,n(NO)=$\frac{12g}{30g/mol}$=0.4mol,设反应前有O2amol,NO的转化率为x,则反应NO0.4xmol,据方程式2NO+O2=2NO2,则反应O20.2xmol,故0.2x+0.05=a①,反应前气体总物质的量为n前=0.4+a,反应后气体总物质的量为n后=0.4+a-0.2x,又因为n前:n后=4:3,故.(4+a):(0.4+a-0.2x)=4:3②,联立①②得x=0.75,a=0.2,故一氧化氮的转化率为$\frac{0.4×0.75}{0.4}×100%$=75%.
答:该温度下一氧化氮的转化率为75%.
点评 解决本题的关键是知道同温同体积时,压强之比等于物质的量之比,本题难度中等.


科目:高中化学 来源: 题型:解答题
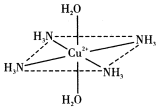 往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:
往硫酸铜水溶液中加入氨水,首先生成难溶物,继续加氨水,难溶物溶解,而且所得溶液的颜色比原来明显加深,得到了一种含2+的溶液,此离子的立体结构如图所示(4个NH3与Cu2+共面,跟H2O-Cu2+-H2O轴线垂直).请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | Cl2+H2O═HClO+HCl | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- | |
| B. | 向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O | |
| C. | 向明矾[KAl(SO4)2•12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
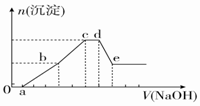 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )| A. | 在0~a段加入的NaOH溶液与NH4Cl反应 | |
| B. | 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3 | |
| C. | c点溶液中溶质只有NaCl | |
| D. | 在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com