
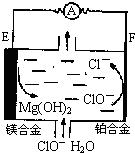
 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
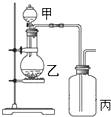 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NH3 | 浓氨水 | CaO | H2O |
| B | 制取并验证C2H2可被KMnO4酸性溶液氧化 | 饱和食盐水 | 电石 | KMnO4酸性溶液 |
| C | 制取并验证Cl2没有漂白性 | 浓盐酸 | MnO2 | 干燥的红布条 |
| D | 制取并验证SO2具有漂白性 | 70%硫酸 | Na2SO3 | 品红试液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,饱和溶液中的Ag+浓度:AgCl>Ag2CrO4>AgI |
| B、向饱和食盐水中加AgNO3,形成AgCl沉淀时,溶液中的Ag+浓度为1.34×10-5 mol?L-1 |
| C、向含AgI难溶物的溶液中,逐滴加入饱和食盐水,原难溶物会变成白色 |
| D、向含Cl-、I-和CrO42-浓度均为0.010 mol?L-1的溶液中,逐滴加入AgNO3溶液,最先形成Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知:C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| B、已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,则氢气的燃烧热为241.8kJ?mol-1 |
| C、已知:500℃、30MPa下,N2(g)+3H2(g)?2NH3 (g)△H=-38.6kJ?mol-1;将1.5molH2和过量的N2在此条件下充分反应,放出热量19.3kJ |
| D、已知:H2(g)+F2(g)═HF(g)△H=-270kJ?mol-1,则相同条件下,2molHF气体的能量小于1mol氢气和1mol氟气的能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素从上到下,单质的熔点逐渐降低 |
| B、同主族元素从上到下,氢化物的熔点逐渐降低 |
| C、同周期元素(除零族元素外)从左到右,简单离子半径逐渐减小 |
| D、同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com