
【题目】下列有关实验室制取气体的反应中,其反应不属于氧化还原反应的是( )
A.实验室中用稀硫酸与Mg反应制取H2B.实验室中用高锰酸钾加热分解制取O2
C.实验室中用H2O2与MnO2作用产生O2D.实验室中用稀盐酸与石灰石反应制取CO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲同学用装置I进行如下实验:
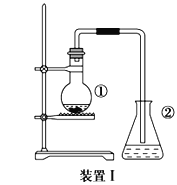
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3溶液的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为__________________________________________________。
(2)①中长导管的作用是______________________________________________。
(3)要得到纯净的产物,可用稀NaOH溶液、蒸馏水洗涤。洗涤分离粗产品后,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A 重结晶 B 过滤 C 蒸馏 D 萃取
(4)乙同学设计如图所示装置II,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴、浓硫酸、氢氧化钠溶液、硝酸银溶液、四氯化碳。
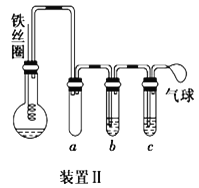
① 能证明苯和液溴发生的是取代反应,而不是加成反应,则试管b中应加入___________,其作用是_________________________;试管c中应加入________________。
② 比较两套装置,装置II的主要优点是_____________________________________。(答出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如图所示,下列推断合理的是
![]()
A.向甲中通入CO2可增大c(NH4+)和c(SO42-)
B.为提高生产效率,通入的NH3和CO2越多越好
C.颠倒NH3与CO2的加入顺序不影响生产效率
D.最后一步得到(NH4)2SO4固体的操作为蒸干滤液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门检测到某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,要求该工厂从该废水中回收硫酸亚铁和金属铜。该工厂设计了如下流程图,完成回收硫酸亚铁和铜的简单实验方案。
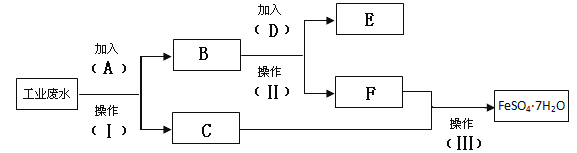
回答下列问题
(1)填写试剂A的化学式 _______________
(2)假如加入2mol D刚好完全反应,此步转移的电子的物质的量为 __________
(3)写出加入A的离子方程式: _________________
(4)操作Ⅱ和III 的名称分别是 ___________、 ____________、________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国部分地区突发的新冠肺炎疫情严重威胁着人们的身体健康。研究发现洛匹那韦对新冠病毒有较好抑制作用,洛匹那韦能溶于水,其结构如图所示,下列说法不正确的是
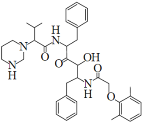
A.洛匹那韦的分子式为C37H48N4O5
B.洛匹那韦能发生取代、加成、消去、氧化、还原反应
C.洛匹那韦的水解产物之一遇Fe3+可显紫色
D.洛匹那韦能溶于水与氢键作用有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。取甲醛amL于锥形瓶,加入1~2滴指示剂,用浓度为bmol/L的NaOH溶液滴定,滴定管的初始读数为V1mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2mL。
②向锥形瓶加入饱和食盐水试样cmL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3mL。
下列说法不正确的是
A.步骤①中的指示剂可以选用酚酞试液
B.步骤②中静置的目的是为了使NH4+和HCHO完全反应
C.步骤②若不静置会导致测定结果偏高
D.饱和食盐水中的c(NH4+)=![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
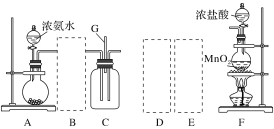
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用含钴废料(主要成分为Co,含有一定量的NiO、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的流程如下:
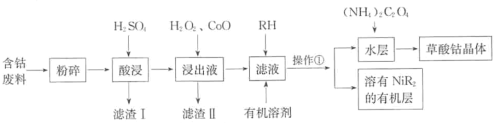
已知:①草酸钴晶体难溶于水:②RH为有机物(难电离)。
回答下列问题:
(1)酸浸时钴溶解反应的化学方程式为_______,浸出液中加入H2O2后发生反应的离子方程式为______。
(2)加入氧化钴的目的是_______,滤渣的II主要成分是_______。
(3)操作①为____________(填操作名称)。
(4)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H ++HC2O 4- Ka1=5.4×10-2
H ++HC2O 4- Ka1=5.4×10-2
HC2O4-![]() H ++C2O42- Ka2=5.4×10-5
H ++C2O42- Ka2=5.4×10-5
该流程中所用(NH4)2C2O4溶液的pH_________(填“>”“<"或"一")7.
(5)钴的含氧酸盐受热分解最终产物多为氧化物,已知18.3g CoC2O4·2H2O热分解质量变化过程如图所示(其中600 °C以前是隔绝空气加热,6000 °C以后是在空气中加热),A、B、C均为纯净物。

①A点对应物质的化学式为________________
②B →C反应的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com