
分析 根据公式m=nM,N=nNA结合微粒的构成情况进行计算即可.
解答 解:S原子的摩尔质量在水数值上等于其相对分子质量,即S原子的摩尔质量是32g/mol,1mol H2SO4的质量是1mol×98g/mol=98g,2mol H2SO4含有氧原子数N=nNA=2mol×4NA=8NA,0.49kgH2SO4的物质的量是$\frac{490g}{98g/mol}$=5mol,Ne是10电子的原子,所以2mol Ne含有20NA个电子,故答案为:32g/mol;98g;8NA;5;20NA.
点评 本题考查学生物质的量的有关计算知识,注意物质的微粒构成以及公式的应用是关键,难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
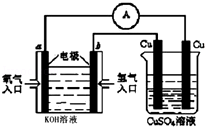 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15k J |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达到平衡时,两个容器中XY3的物质的量浓度均为2mol/L | |
| C. | 容器②中反应达到平衡时吸收的热量为QkJ | |
| D. | 若容器①的体积为0.2L,则达到平衡时放出的热量大于23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{6}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 今年,中国女科学家屠呦呦获得诺贝尔奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )
今年,中国女科学家屠呦呦获得诺贝尔奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )| A. | 青蒿素与维生素C一样易溶于水工作 | |
| B. | 所有碳原子都可能在同一平面上 | |
| C. | 青蒿素晶体为分子晶体,其化学式为C15H22O5 | |
| D. | 含有酯基,在胃酸作用下能水解,其水解产物能使氯化铁溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com