
| A. | 在0.01mol•L-1Ba(OH)2溶液中:Na+、NH4+、NO3-、HCO3- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Fe2+、NO3-、Cl- | |
| C. | pH=7的溶液中:K+、Cl-、Br-、Fe3+ | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、I-、SO42- |
分析 A.0.01mol•L-1Ba(OH)2溶液呈碱性;
B.使甲基橙变红色的溶液呈酸性;
C.Fe3+水解呈酸性;
D.水电离的c(H+)=1×10-13mol•L-1的溶液呈酸性或碱性.
解答 解:A.0.01mol•L-1Ba(OH)2溶液呈碱性,碱性条件下NH4+、HCO3-不能大量存在,故A错误;
B.使甲基橙变红色的溶液呈酸性,酸性条件下Fe2+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.Fe3+水解呈酸性,不能存在中性溶液中,故C错误;
D.水电离的c(H+)=1×10-13mol•L-1的溶液呈酸性或碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握题目要求以及常见离子的性质和反应类型的判断,答题时注意题给信息,难度不大.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和N2 | B. | N2H4 和C2H4 | C. | CO2和N2O | D. | O3和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol气态H2与1mol气态氧气完全燃烧生成2mol液态水时放出571.6 kJ的热量 | |
| B. | 1mol气态H2与0.5mol气态氧气完全燃烧生成1mol液态水时吸收285.8kJ的热量 | |
| C. | 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热量 | |
| D. | 上述热化学方程式可表示为H2(g)+O2(g)=H2O(1),H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 食用油和汽油都属于酯类,都能用来工业上制肥皂 | |
| C. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| D. | 地沟油若被回收重新流入餐桌,对人体伤害极大,应倡导加工处理生成生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
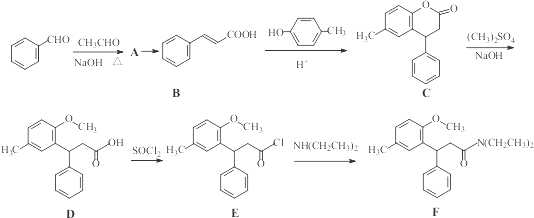
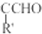
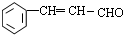 .
.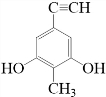 等.(任写一种)
等.(任写一种)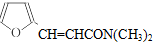 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子结构示意图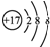 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式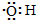 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: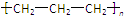 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
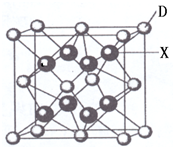 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com