
短周期元素X、Y、Z三种原子核外电子总数为32,都可形成常温下气体单质。X原子最外层电子数是其内层电子数的3倍;Y的气态氢化物与其最高价氧化物对应的水化物恰好反应的产物只有一种A,A的水溶液显酸性。下列说法正确的是
A.原子半径: Z>X >Y
B.X元素形成的单质其摩尔质量一定是32g·moL-1
C.物质A中既含离子键又含共价键
D.YX2、ZX2都有对应的含氧酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
已知25℃,Fe(OH)3(s) Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O
Fe3+(aq)+3OH-(aq),Ksp;Fe3++3H2O Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
Fe(OH)3+3H+,Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是
A.Ksp·Kh=Kw3 B.Ksp·Kw=Kh
C.Kh/Kw=Ksp D.Kw/Kh=Ksp3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列关于实验操作的叙述正确的是
A.用四氯化碳萃取溴水中的溴时,将溴的四氣化碳溶液从分液漏斗下口放出
B.用氢氧化钠溶液滴定盐酸的实验中,可通过旋转玻璃活塞调节滴定速率
C.在配制一定物质的量浓度溶液的实验中,若定容时加水超过刻度线应立即用滴管吸出少量水
D.用玻璃棒蘸取溶液滴到放在洁净表面皿上用蒸锻水润湿的pH试纸上,测溶液的pH
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【有机物化学基础】
以下是一种药物Ⅳ合成部分路线:

请回答下列问题:
(1)化合物Ⅰ的分子式为 ,它长期暴露在空气中会变质,其原因是 。
(2)化合物Ⅰ转化为Ⅱ的反应类型是 。
(3)化合物Ⅰ的同分异构体A含α-氨基苯乙酸,A的苯环对位含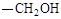 ,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
(4)写出Ⅲ的结构简式 。
(5)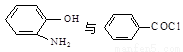 在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
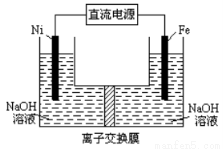
A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解 时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
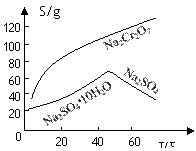
从化工厂铬渣中提取硫酸钠的工艺如下:
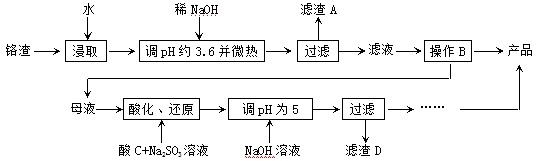
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+ ;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
【选项】
A.K+、Ca2+、Br-、Cl- B.NH3·H2O、SO32-、K+、Na+
C.Fe2+、Na+ 、K+、NO3- D.Na+ 、Mg2+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
已知:硫酸铜溶液中滴入氨基乙酸钠(H2 N—CH2—COONa)即可得到配合物A。其结构如右图:
N—CH2—COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为  。
。
(2)1mol氨基乙酸钠中含有σ键的数目为 。
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式)。已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 。
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如右图,则该化合物的化学式是 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:选择题
下列说法正确的是
A.欲配制1.00L 1.00mol·L-1的NaCI溶液,可将58.5g NaC1溶于1.00L水中
B.0.2mol Na2O2与足量水反应,转移电子数为0.4NA
C.同温同压下,质量相同的SO2气体和CO2气体的体积比等16:11
D.1.0L 1.0mol ·L-l的Na2CO3水溶液中含有的氧原子数大于2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com