
| A. | 15 | B. | 14 | C. | 13 | D. | 10 |
分析 有机物烃燃烧的通式为CxHy+(x+$\frac{y}{4}$)O2→xCO2+($\frac{y}{2}$)H2O,x=2,y=2,据此写出乙炔反应的方程式,注意最后将方程式系数化成最简整数,计算a、b、c、d之和.
解答 解:依据有机物烃燃烧的通式为CxHy+(x+$\frac{y}{4}$)O2→xCO2+($\frac{y}{2}$)H2O,可知当x=2,y=2,即2C2H2+$\frac{5}{2}$ O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,方程式系数为正整数,所以乙炔燃烧的方程式为:2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,所以a、b、c、d之和为:2+5+4+2=13,
故选:C.
点评 本题考查了有机物烃燃烧的方程式的配平,明确烃燃烧规律是解题关键,注意方程式系数为正整数,题目不难.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
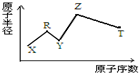 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
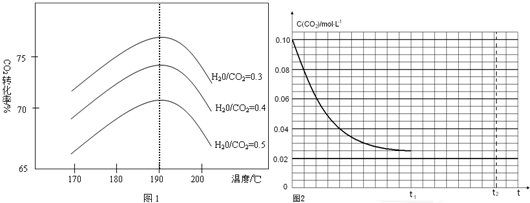
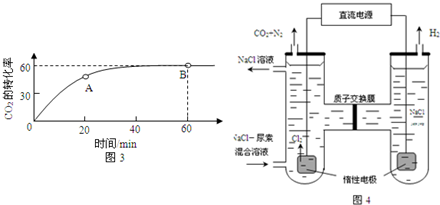
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X由四种元素组成 | B. | X是化合物 | C. | X中有水 | D. | X 很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
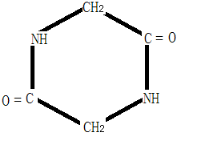 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=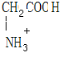 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com