
【题目】常温下,HF的电离常数Ka=6.61×10-4,NH3﹒H2O电离常数Kb=1.78×10-5。下列说法正确的是
A.NH4F溶液中![]()
B.NH4F溶液中水的电离程度小于纯水的电离程度
C.NH4F溶液中F-的水解平衡常数Kh(F-)=1.51×10-11
D.NH4F与NH4Cl的混合溶液中有下列关系:c(NH4+)>c(F-)+c(Cl-)
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
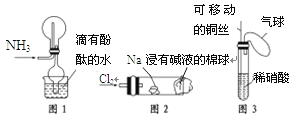
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L浓度均为![]() 和氢氧化钠的混合溶液中缓慢加入二氧化碳,随
和氢氧化钠的混合溶液中缓慢加入二氧化碳,随![]() 增大,溶液中下列离子浓度对应关系正确的是 ( )
增大,溶液中下列离子浓度对应关系正确的是 ( )
选项 |
| 溶液中离子的物质的量浓度关系 |
A |
| c(Na+)>c(CO32-)>c(OH-)>c(AlO2-) |
B |
|
|
C |
|
|
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解.
(1)探究草酸的酸性
①已知:25℃H2C2O4的电离常数 K1=5.4×10-2,K2=5.4×10-5;H2CO3的电离常数 K1=4.5×10-7,K2=4.7×10-11,则下列化学方程式正确的是___(填选项序号,下同)
A.H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液.混合溶液中c(H+)>c(OH﹣),下列说法中正确的是___.
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH﹣)
C.c(OH﹣)=c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应).
实验步骤:准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
高锰酸钾溶液应装在__________滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是_____________;
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视 D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氢氟酸溶液中,存在如下电离平衡:HFH++F-
(1)加入固体NaOH,电离平衡向______反应方向移动,c(H+)______ .
(2)加入固体NaF,电离平衡向______反应方向移动.
(3)升高温度,电离平衡向______反应方向移动.
(4)常温下,小苏打溶液呈______性,原因是_________________________(用必要的离子方程式及文字解释表示).
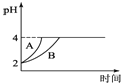
(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是 ______(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2则m1______m2(选填“>”、“=”“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应![]() ,下列叙述正确的是
,下列叙述正确的是
A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少
B.化学反应速率关系是:![]()
C.达到化学平衡时,![]()
D.若单位时间内生成![]() 的同时,消耗
的同时,消耗![]() ,则反应达到平衡状态
,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:![]() 该反应在恒容的密闭容器中进行,下列有关说法正确的是
该反应在恒容的密闭容器中进行,下列有关说法正确的是![]()
A.当生成速率![]() :
:![]() :1时反应达到平衡
:1时反应达到平衡
B.平衡后保持其他条件不变,分离出部分MgO,平衡向正反应方向移动
C.平衡后保持其他条件不变,通入CO再次平衡时CO与![]() 的物质的量之比减小
的物质的量之比减小
D.平衡后保持其他条件不变,升高温度CO的转化率及该反应的化学平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)可用于烟火和陶瓷工业,该物质是矿物天青石的主要成分,可有Na2SO4溶液加入锶盐溶液沉淀而得。如图是硫酸锶的溶解曲线,下列说法正确的是
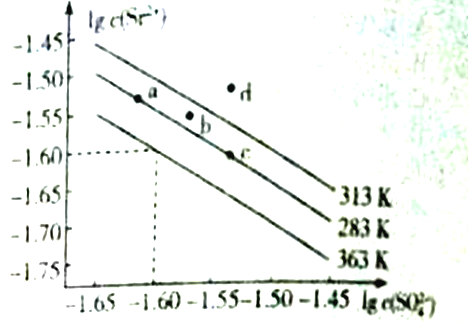
A. 图像中a、c两点的溶度积:Ksp(a)<Ksp(c)
B. 363K时的溶度积Ksp(SrSO4)=1.0×10-3.20
C. SrSO4的溶解度随温度升高而增大
D. 313K时,b点为饱和溶液,d点为不饱和溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com