
 化学是一门以实验为基础的学科.
化学是一门以实验为基础的学科.分析 (1)A.Na性质活泼,与氧气、水均反应;
B.具有塞子或活塞的仪器使用前需要检查是否漏液;
C.灼烧海带在坩埚中进行;
D.亚铁离子具有还原性,加氧化剂不能引入新杂质;
E.加入BaCl2溶液,产生白色沉淀,白色沉淀可能为亚硫酸钡;
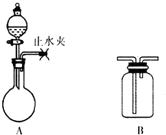
(2)①由图中装置可知,关闭止水夹,利用液差法检验气密性;
②利用A装置在加热条件下制取Cl2,选择浓盐酸与二氧化锰反应;
③碳酸氢钠与HCl反应生成二氧化碳.
解答 解:(1)A.Na性质活泼,与氧气、水均反应,且Na的密度比煤油大,则金属钠通常保存在煤油中,防止因接触空气而变质,故正确;
B.具有塞子或活塞的仪器使用前需要检查是否漏液,则容量瓶、分液漏斗在使用时需要检验是否漏水,故正确;
C.灼烧海带在坩埚中进行,需要的仪器为坩埚、泥三角、三角架、玻璃棒、酒精灯,故错误;
D.亚铁离子具有还原性,加氧化剂不能引入新杂质,则通入Cl2或滴加H2O2均可以除去Fe2+,故正确;
E.加入BaCl2溶液,产生白色沉淀,白色沉淀可能为亚硫酸钡,再加硝酸发生氧化还原反应生成硫酸钡沉淀,沉淀不溶解,不能说明是否氧化,故错误;
故答案为:ABD;
(2)①关闭A装置中的止水夹,向分液漏斗中加入适量水,打开活塞,说明A装置气密性良好的现象是分液漏斗内液面高度保持不变(或液体不再滴下),
故答案为:分液漏斗内液面高度保持不变(或液体不再滴下);
②利用A装置在加热条件下制取Cl2,选择浓盐酸与二氧化锰反应,离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
③用B装置除去CO2中混有的HCl气体,试剂为饱和碳酸氢钠溶液,除去HCl,同时抑制CO2气体的溶解,故答案为:饱和碳酸氢钠溶液.
点评 本题考查化学实验方案的评价及气体的制备实验,综合性较强,侧重分析与实验能力的综合考查,把握物质的性质、实验技能为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3可用于中和胃酸过多 | |
| B. | 硅用于制造光导纤维 | |
| C. | 氯气与澄清石灰水反应制漂白粉 | |
| D. | 医疗上通常直接用无水乙醇进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识 | |
| B. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 人体需要的营养物质-蛋白质、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
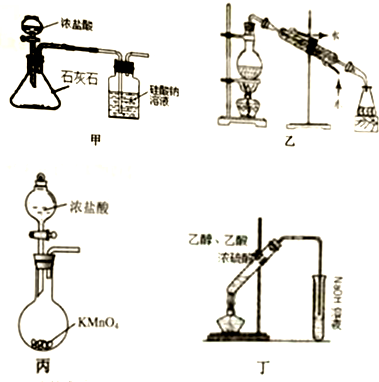
| A. | 装置甲:验证碳的非金属性比硅强 | |
| B. | 装置乙:石油分馏分别得到汽油、柴油、煤油 | |
| C. | 装置丙:实验室制取氯气的反应发生装置 | |
| D. | 装置丁:实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
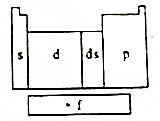 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.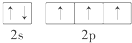 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ ④CH3COOH
④CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以使用排水法收集氨气 | |
| B. | Na2O2既含有离子键,又含有非极性键 | |
| C. | 金属元素从游离态变为化合态一定被氧化 | |
| D. | Na2CO3饱和溶液中持续通入CO2气体有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
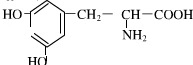 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com