
【题目】托特罗定(G)是毒蕈碱受体拮抗剂,其一种合成路线流程图如下:
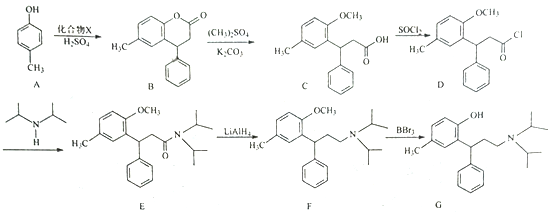
(1)C中含氧官能团名称为__________和__________。
(2)D生成E的反应类型为__________。
(3)化合物X的分子式为C9H8O2,写出X的结构简式:__________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:__________。
能发生水解反应,两种水解产物均能与FeCl3溶液发生显色反应且分子中均只有4种不同化学环境的氢。
(5)已知:R1-CHO![]()
![]() (R1、R2代表烃基或H)
(R1、R2代表烃基或H)
请写出以![]() 、CH3CHO和(CH3)2SO4为原料制备
、CH3CHO和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________________
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。

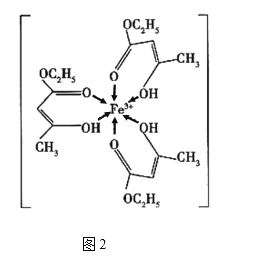
回答下列问题
(1)基态Cu原子的核外电子排布式为____________________________。
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)________I1(Cu)(填“>“<”或“=”)
(3)化合物A的化学式为____________,Cl原子的配位数是____________。
(4)B中碳原子的杂化轨道类型为________,含有的化学键为________(填字母)。
a.离子键 b.金属键 c.极性键 d.非极性键
e.配位键 f.氢键 g.σ键 h.π键
(5)化合物A难溶于水,但易溶于氨水,其原因可能是________________;与NH3互为等电子体的分子有________________(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是________________________________________。
(6)已知化合物A晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中两个Cu原子之间的最短距离为________________________nm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是 ( )
A. 某无色溶液中可能大量存在H+、Cl-、MnO、K+
B. 使红色石蕊试纸变蓝的溶液中,H+、Al3+、Cl-、NO3-
C. Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+===2Fe3++2H2O
D. 稀硫酸与Ba(OH)2溶液的反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应不属于氧化还原反应的是
A. 2NaOH+H2SO4===Na2SO4+2H2O B. 3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
C. 2Na+2H2O====2NaOH+H2↑ D. 2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,配制一组c(H2CO3)+c(HCO3-)+c(CO32-)=1.000×10-3mol·L-1的H2CO3与HCl或H2CO3与NaOH的混合溶液,溶液中部分微粒浓度的负对数(-lgc)与pH关系如下图所示。下列说法正确的是( )
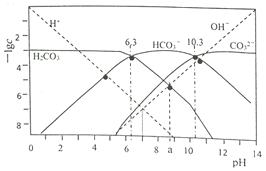
A. pH=6.3的溶液中:c(Na+)>1.000×10-3mol·L-1
B. pH=7的溶液中:c(Na+)>c(H2CO3)>c(CO32-)
C. pH=a的溶液中:c(HCO3-)>c(Na+)>c(H+)>c(CO32-)
D. 25℃时,反应H2CO3+CO32-![]() 2HCO3-的平衡常数为1.0×104
2HCO3-的平衡常数为1.0×104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废雷尼镍(主要成分为NiO、Al,少量Cr、Fe、C、S及有机物)制备Ni(NO3)2·6H2O的实验流程如下:
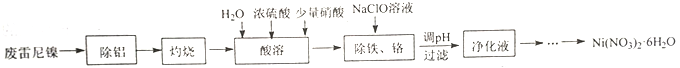
已知:①在实验条件下,Ni2+、Cr3+在溶液中不能被NaClO或HNO3氧化。
②NiSO4易溶于水,NiCO3难溶于水;Ni(NO3)2在20℃、90℃时溶解度依次为79.2、188g/100g水。
③己知“酸溶”后的溶液中主要的四种离子开始沉淀与沉淀完全的pH如下:
Ni2+ | Fe2+ | Fe3+ | Cr3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.5 |
沉淀完全pH | 8.5 | 9.1 | 3.3 | 5.6 |
(1)“除铝”所用试剂及主要操作为__________。
(2)“灼烧”的主要目的是__________。
(3)“酸溶”时,用浓硫酸和水代替稀硫酸的目的是__________。
(4)“除铁、铬”时,Fe2+被氧化为Fe3+的离子方程式为__________;氧化后需将溶液pH调整到的范围是__________。
(5)请设计由“净化液”制取Ni(NO3)2·6H2O的实验方案:__________,离心分离、洗涤、干燥得Ni(NO3)2·6H2O (实验中须使用的试剂有:6mol·L-1硝酸,3 mol·L-1Na2CO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家冶炼出了纯度高达99、9999%的铁,你估计它不会具有的性质是
A. 硬度比生铁高 B. 在潮湿的空气中放置不易生锈
C. 与4mol/L盐酸的反应生成氢气 D. 在冷的浓H2SO4溶液中可钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S以及COS(羰基硫)是化学工作者重要的研究对象。请回答下列问题:
(1)COS的分子结构与CO2相似,COS的电子式为_________。
(2)已知:①COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=-17KJ/mol
H2S(g)+CO(g) ΔH1=-17KJ/mol
②COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-35kJ/mol
H2S(g)+CO2(g) ΔH2=-35kJ/mol
③CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH3
H2(g)+CO2(g) ΔH3
则ΔH3=__________
(3)已知常温下,Ksp(CuS)=1.0×10-39,Ksp(PbS)=9.0×10-29。向含有浓度均为0.01mol/L的Cu2+、Pb2+废水中缓慢通入H2S,首先生成的沉淀的化学式是_______;当生成两种沉淀时,c(Pb2+)/c(Cu2+)=__________.
(4)某温度T下,在密闭容器中充入5molH2O(g)和5molCOS(g),测得混合气体中H2S体积分数(Φ)与时间(t)的关系如图所示。
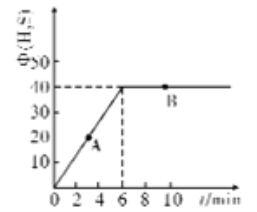
①A点COS的正反应速率_______(填“大于”“小于”或“等于”)B点COS的逆反应速率。
②在该条件下,COS的平衡转化率为________
③在该温度下,该反应的平衡常数K=__________
④在B点对应的体系中,改变下列条件,能使COS转化率增大的是______
A.再通入H2O(g) B.加压 C.降温 D.加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是()
A.SO2能使品红溶液褪色,说明SO2具有漂白性
B.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
C.用HF来刻蚀玻璃,说明SiO2是碱性氧化物
D.雨水显酸性是因为吸收了空气中的CO2,pH小于1的雨水称为酸雨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com