
以NA表示阿伏加德罗常数,下列说法错误的是()
A. 1mol P4中P﹣P键的数目为6NA
B. 1mol Na2O2晶体中含有阴阳离子总数为4NA
C. 30g SiO2晶体中含有Si﹣O键数目为2NA
D. 6g金刚石中含有的碳碳键数目为1NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.白磷分子P4中含有6个P﹣P键;
B.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子;
C.1molSiO2晶体存在4molSi﹣O键;
D.金刚石的构型是网状构型,每个碳原子上共有4个单键与其他4个碳原子公用,每个碳原子含两个碳碳单键.
解答: 解:A.白磷分子P4中含有6个P﹣P键,1mol P4中P﹣P键的数目为6NA,故A正确;
B.1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,故B错误;
C.1molSiO2晶体存在4molSi﹣O键,所以30gSiO2晶体即0.5mol含有2molSi﹣O键,故C正确;
D.金刚石的构型是网状构型,每个碳原子上共有4个单键与其他4个碳原子公用,即每个碳原子含两个碳碳单键,所以0.5mol的金刚石含有1NA个碳碳单键,故D正确.
故选B.
点评: 本题考查了阿伏伽德罗常数,题目难度中等,该考点是2015届高考考查的重点和难点,试题综合性强,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
目前市场上有大量的铝质罐装饮料,采用铝质易拉罐的原因可能考虑的因素有 ( )。
①铝矿储量较丰富,原料成本低 ②包装、运输、存放等方面比较方便、易
行 ③用过的铝质易拉罐可以回收再利用 ④铝制品对人体健康没有不良影
响,可以放心使用
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
| 元素代号优高考网] | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
A.由Q与Y形成的化合物中只存在离子键 B、Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,一定是共价分子 D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是原子序数依次增大的四种短周期元素,它们分别按原子个数1∶1组成甲、乙、丙、丁四种物质。已知:甲由A、B组成,常温为气态;乙由A、C组成,常温为液态;丙由A、D组成,丁由C、D组成,丙、丁均为离子化合物。
根据以上信息回答:
(1)D在周期表中处于第________周期________族;乙的电子式为________;丙的化学式为________。
(2)丁遇水易变质,请用化学方程式解释:______________________。
(3)标准状况下,5.6 L甲完全燃烧生成稳定氧化物放出325 kJ热量,则甲燃烧热的热化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是()
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在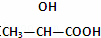 分子中含有1个手性C原子
分子中含有1个手性C原子
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2﹣和C﹣,B2+和C﹣具有相同的电子层结构,下列说法正确的是()
A. C元素的最高正价为+7价 B. 原子半径:A>B>C
C. 离子半径:A2﹣>C﹣>B2+ D. 还原性:A2﹣<C﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
(1)与OH﹣互为等电子体的一种分子为HF(填化学式).
(2)葡萄糖等很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2 ②CH≡CH③ ④HCHO等,
④HCHO等,
其中Ⅰ:①中含有的官能团名称是 、③的分子式为 .
Ⅱ:②中碳原子的轨道杂化类型是 ;④的立体构型为 .
(3)Cu属于 区元素,基态Cu+核外价电子排布式为
铜的另一种价态的离子Cu2+的水合离子中,提供孤电子对的原子是 .
(4)将氨气通入到Cu(OH)2悬浊液的离子方程式为 .
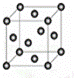
(5)Cu2O在稀硫酸中生成Cu和CuSO4,请写出该反应的化学方程式: .铜晶胞结构如右图所示,铜晶体中每个铜原子周围等距离且最近的铜原子数目为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
酚酞是一种重要的酸碱指示剂,它是一种弱酸,其结构如图所示.一定条件下,1mol酚酞与H2反应、1mol酚酞与溶液中的NaOH反应的最大量分别为( )

|
| A. | 9mol,3mol | B. | 9mol,2mol | C. | 10mol,3mol | D. | 10mol,4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应( )
NH3+CO2―→NNNHOOHOH+H2O
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com