
| A. | K+一定存在,且c(K+)≥0.02mol•L-1 | B. | 100mL溶液中含CO32-0.0lmol | ||
| C. | K+不一定存在 | D. | Cl-一定存在 |
分析 Ca2+、Ba2+和SO42-可发生离子反应生成沉淀,不能共存;Ca2+、Ba2+和CO32-可发生离子反应生成沉淀,不能共存.
第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-.
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+.故可确定一定含有NH4+,一定不存在Mg2+.根据反应NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,产生NH3为0.04mol,可得NH4+也为0.04mol.
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ca2+、Ba2+.
由条件可知BaSO4为2.33g,物质的量为$\frac{2.33g}{233g/mol}$═0.01mol,
BaCO3为6.27g-2.33g═3.94g,物质的量为$\frac{3.94g}{197g/mol}$═0.02mol,
则CO32-物质的量为0.02mol,CO32-物质的量浓度为$\frac{0.02mol}{0.1L}$═0.2mol/L,
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Ca2+、Ba2+,结合电荷守恒解答该题.
解答 解:由以上分析可知溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+,不能确定是否存在K+、Cl-,
A.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且c(K+)≥$\frac{0.06mol-0.04mol}{0.1L}$=0.02mol•L-1,故A正确;
B.由上述分析可得,CO32-物质的量为0.02mol,故B错误;
C.由选项A可知,K+一定存在,故C错误;
D.CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还存在Cl-,即不一定存在Cl-,故D错误;
故选A.
点评 本题考查常见离子的推断,为高频考点,把握离子反应、物质的量计算、电荷守恒为解答的关键,侧重分析与实验能力的考查,注意钾离子的确定方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )
,由于醚键比较稳定故利用 此反应可保护醛基,也可以合成缩醛类有机物,下列说法中不正确的是( )| A. | 保护 1mol 醛基时也可用2molCH3CH2OH | |
| B. | 合成 1mol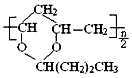 需要 1mol 需要 1mol 和 nmolCH3CH2CH2CHO 和 nmolCH3CH2CH2CHO | |
| C. | 通过上述反应合成的 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 其核磁共振氢谱中峰面积之比为1:1:1:1:1:2:2:3 | |
| D. | 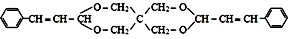 可由 C(CH2OH)4 与 可由 C(CH2OH)4 与 通过上述反应得到 通过上述反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{△{H}_{1}}{△{H}_{2}}$mol | B. | $\frac{2△{H}_{1}}{△{H}_{2}}$mol | C. | $\frac{△{H}_{1}}{2△{H}_{2}}$mol | D. | -$\frac{△{H}_{1}}{2△{H}_{2}}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com