
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:
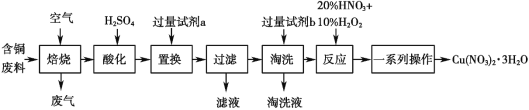
(1)“焙烧”过程中除生成 SO2 的反应外,另外一个反应的化学方程式是______。
(2)“酸化”过程为加快反应速率,可采用的措施有______(写出一条即可)。
(3)若试剂 a 为 Zn,则“置换”的离子方程式为_____。
(4)“淘洗”的作用是_________________。
(5)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为_______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
【答案】2Cu +O2![]() 2CuO 升高温度 Cu2+ + Zn ══ Cu + Zn2+ 除去过量的锌 Cu+ H2O2 + 2H+═ Cu + 2H2O 1 :2
2CuO 升高温度 Cu2+ + Zn ══ Cu + Zn2+ 除去过量的锌 Cu+ H2O2 + 2H+═ Cu + 2H2O 1 :2
【解析】
废料中的铜元素有两种价态:0价和+2价,而目标产品Cu(NO3)2·3H2O中铜元素显+2价,过程中应该有氧化还原反应发生,废料中硫元素等杂质要除去。由流程图分析,将废料“焙烧”时Cu和CuS将被O2氧化生成固体CuO和气体SO2。用H2SO4“酸化”有发生反应CuO+H2SO4=CuSO4+H2O,所以酸化得到的溶液主要是CuSO4溶液。加入“过量试剂a”的目的是通过“置换”反应得到单质铜,试剂a应选择比铜活泼的金属单质。“置换”后“过滤”所得固体是铜单质(含有过量的锌),“淘洗”目的就是除去过量的金属锌。“反应”步骤中金属铜溶解在20%HNO3和10%H2O2溶液中,得到Cu(NO3)2溶液,最后经一系列操作得到目标产品[Cu(NO3)2·3H2O]。
(1)废料中Cu和CuS在“焙烧”过程中与O2反应,CuS将转化为CuO和SO2,所以另外一个反应的化学方程式为2Cu+O2![]() 2CuO。
2CuO。
(2)“焙烧”后的固体用硫酸酸化,根据影响化学反应速率的外界因素可知,加快反应速率的措施有:①升高温度;②在一定范围内增大硫酸的浓度;③将“焙烧”后的固体粉碎。(任选一条回答即可)
(3)Zn比Cu活泼,能够将溶液中的Cu2+置换,其离子方程式为Cu2++Zn=Cu+Zn2+。
(4)在“置换”步骤中加入了过量的锌,得到的固体铜中含有锌,为了不影响产品的纯度必须除去锌,所以“淘洗”的作用就是除去过量的锌。
(5)从目标产物看,“反应”步骤应该是将单质铜转化为Cu(NO3)2的过程,铜元素被氧化,而“整个过程无红棕色气体产生”说明氧化剂不是HNO3,可推知该过程作为氧化剂的物质应是H2O2,所以发生反应的离子方程式为:Cu+H2O2+2H+═ Cu+2H2O。若该步骤只使用20% HNO3且出现大量红棕色气体,可推知该过程起氧化剂作用的是HNO3,还原产物是红棕色的NO2气体,化学反应方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,因4molHNO3中只有2molHNO3起氧化剂作用,所以还原剂(Cu)与氧化剂(HNO3)物质的量之比为1:2。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中,正确的是
A.合金的熔点一定比各成分金属的低
B.钢是目前用量最大、用途最广的合金
C.在我国使用最早的合金是生铁
D.储氢合金能大量吸收H2,但不与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应 2SO3(g)![]() 2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
2SO2(g)+O2(g),若反应物浓度由1 mol/L降到0.8 mol/L需10s,那么由0.8 mol/L降到0.4 mol/L,需反应的时间为
A. 等于10sB. 小于10sC. 等于20sD. 大于20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.SiO2溶于水显酸性
B.SiO2是酸性氧化物,它不能与任何酸发生反应
C.Si是地壳中含量最多的非金属元素
D.硅的化学性质不活泼,但在自然界中主要以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LCHCl3 中含有氯原子数目为 3NA
B. 18g D2O 和 18g H2O 中含有的质子数均为 10NA
C. 4.6gNa 与 O2反应生成 Na2O 和 Na2O2 混合物时失去的电子数为 0.2NA
D. 25℃时 pH=13 的 Ca(OH)2溶液中含有 OH-的数目为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用水可以鉴别苯、四氯化碳、乙醇三种无色液体
B. 用Cu(OH)2悬浊液可以鉴别乙醇、乙酸溶液、葡萄糖溶液
C. 石油的分馏、煤的液化和气化都是物理变化,石油的裂化、裂解都是化学变化
D. 制取环氧乙烷:2CH2=CH2+O2Ag,250℃2![]() ,符合绿色化学的理念
,符合绿色化学的理念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应S(s)+O2(g)![]() SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
SO2(g)△H<0,在其他条件不变时,改变其中一个条件,则生成SO2的速率:(填增大,减小或不变)
(1)升温_____;
(2)增大压强_____;
(3)增大容器容积____;
(4)加入O2____;
(5)加入S_____;
(6)加正催化剂_____。
(7)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______。
A.消耗1molO2同时生成1molSO2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.v正(O2)=v逆(SO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1molCH4和4molCl2反应生成的有机物分子总数为4NA
B. 0.1molH35Cl中含有的质子数目或中子数目均为1.8NA
C. 常温下,22.4L乙烯中含有的共用电子对数目为6NA
D. 1molN2与足量H2发生合成氨反应时转移的电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列表述不正确的是 ( )
A. 标准状况下,22.4L氢气所含原子数是2NA
B. 5.4g水所含的分子数为0.3NA
C. 含1mol硫酸钾的溶液中硫酸根离子数为2NA
D. 14g氮气所含有的原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com