
分析 MnO2的物质的量为$\frac{30g×72.5%}{87g/mol}$=0.25mol,根据方程式计算消耗HCl的物质的量、生成氯气物质的量,再根据V=$\frac{n}{c}$计算消耗盐酸的体积,根据V=nVm计算氯气体积.
解答 解:MnO2的物质的量为$\frac{30g×72.5%}{87g/mol}$=0.25mol,则:
MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2 +Cl2 ↑+2H2O
1 4 1
0.25mol 1mol 0.25mol
(1)参加反应的浓盐酸的体积为$\frac{1mol}{12mol/L}$=0.0833L=83.3mL
答:参加反应的浓盐酸的体积为83.3mL;
(2)标况下,生成氯气的体积为0.25mol×22.4L/mol=5.6L,
答:标况下,生成氯气的体积为5.6L.
点评 本题考查化学方程式计算,比较基础,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 纯碱溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氢氧化铜溶于氢溴酸:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
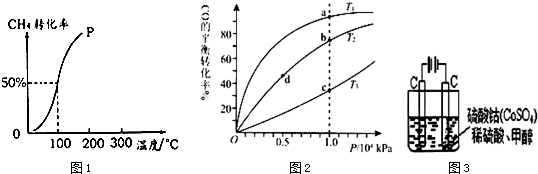
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

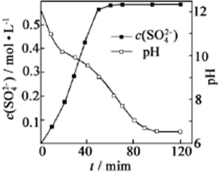
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com