
实验可提供的药品有:①NH4Cl、Ca(OH)2的混合物;②氨水;③KClO3和MnO2;④蒸馏水;⑤0.5 mol/L NaOH溶液;⑥酚酞试液;⑦浓H2SO4;⑧6 mol/L NaOH溶液。

试完成下列问题:
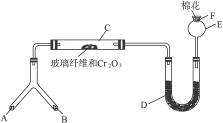
(1)微型叉形管中液态物质A是_____________,固体物质B是_____________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是_______________,实验过程中的现象是_____________。
(4)F处的棉花应蘸取的物质是_____________。
(1)氨水 KClO3和MnO2的混合物
(2)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(3)0.5 mol/L NaOH溶液和酚酞试液 红色褪去
(4)碱性溶液,即为6 mol/L NaOH溶液(浓度大,对气体的吸收效果好)
解析:(1)实验者的目的是制取氨气并做氨的催化氧化实验,因此微型叉形管中必然产生NH3和O2。分析实验提供的药品,可得出液态物质A为氨水,固体物质B是KClO3和MnO2的混合物。
(2)由装置图可以看出:Cr2O3为氨的催化氧化的催化剂,C处发生反应的化学方程式4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(3)检验酸的方法常用酸碱指示剂或pH试纸,由题目所提供药品,只能选择0.5 mol/L NaOH溶液和酚酞试液,实验过程中的现象是红色褪去。
(4)由于反应生成的氨气少,空气量多,因此可基本保证氨气无剩余(即使剩余,也溶解在U形管内的D溶液中)。从溶液中逸出的气体可能为NO,与U形管上方的空气接触,生成NO2,故F处的棉花应蘸取的物质应是碱性溶液,即为6 mol/L NaOH溶液(浓度大,对气体的吸收效果好)。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
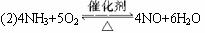
实验中所用试剂不超出下列范围:
①NH4Cl和Ca(OH)2的混合物 ②4∶1氨水 ③NaOH固体 ④KClO3和MnO2的混合物 ⑤蒸馏水⑥NH4HCO3固体 ⑦6 mol·L-1 NaOH溶液 ⑧0.5 mol·L-1 NaOH溶液 ⑨酚酞试液 ⑩碱石灰 ⑾浓H2SO4 ?⑿CuO
试完成下列问题:
(1)微型叉形管中液态物质A是__________,固体物质B是__________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是__________,实验过程中的现象是_______________________。
(4)E处球形玻璃管的作用是________________________________________。
(5)F处的棉花应蘸取的物质是_________________________________,其反应的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点,下图是某同学设计的NH3的催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均略去)。
实验中所用试剂不超出下列范围:
①NH4Cl和Ca(OH)2的混合物 ②4∶1氨水 ③NaOH固体 ④KClO3和MnO2的混合物 ⑤蒸馏水⑥NH4HCO3固体 ⑦6 mol·L-1 NaOH溶液 ⑧0.5 mol·L-1 NaOH溶液 ⑨酚酞试液 ⑩碱石灰 11浓H2SO4 ?12CuO
试完成下列问题:
(1)微型叉形管中液态物质A是__________,固体物质B是__________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是__________,实验过程中的现象是_______________________。
(4)E处球形玻璃管的作用是________________________________________。
(5)F处的棉花应蘸取的物质是_________________________________,其反应的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
例新装修的居室内,甲醛浓度往往很大.严重污染空气.居住者接触时间较长易得白血病。1×10—5mol·L—1的紫色KMnO4溶液遇甲醛气体即褪色。用下面的微型化学实验可测定室内空气甲醛含量:
(1) 试设计实验,在中学实验室里配制100mL l.00×10-4mol·L-1KMnO4溶液;
(2) 用2.5mL注射器准确量取2mL l.00×10—4mol·L—1KMnO4溶液,注入六孔穴板1*孔内,加入3滴6 mol·L—1H2SO4溶液,盖好塞子;按图连接好装置。将此装置置于待测地点,缓慢抽气,每次抽气50mL,直到溶液红色褪去,记录抽气次数。已知有关反应为:5HCHO+4KMnO4+6H2SO4![]() 5CO2+11H2O+2K2SO4+4MnSO4
5CO2+11H2O+2K2SO4+4MnSO4

(3) 设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。
(4) 若室内空气中甲醛气体最高允许浓度为20mg·m-3试分析讨论室内空气符合标准时n的取值范围。
(5) 为保证实验结果精确性,实验过程中应注意什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
某学校化学兴趣小组欲探究钠、钾与空气中的氧气反应的剧烈程度,并且想利用微型化学实验这种实验手段进行实验。
①[实验用品]:玻璃管(直径6-10mm,长100mm)、试管夹、小刀、镊子、滤纸、钠、细玻璃棒。还需要哪些实验仪器 _________________ 。
②[实验方法]:学生甲、乙分别用小刀切取黄豆粒大小的一块钠(钾),并用滤纸吸干其表面的煤油,手持玻璃管,将玻璃管口扣压到钠块(或者钾块)上,稍微向下用力,使钠(钾)块进入玻璃管;用细玻璃棒将钠(钾)块推送到玻璃管中间部位;然后用试管夹夹持装有钠(钾)块的玻璃管,在酒精灯火焰上加热钠(钾)块所在部位,直至钠(钾)块时隐时现地燃烧时,则停止加热。可甲、乙两位同学发现钠、钾在空气中燃烧剧烈程度并没有很大差别,请你帮助他们分析实验失败的原因: ___ 。
③[实验改进]:学生乙认真分析实验失败的原因后,又重复了上述实验步骤,但在加热至钠(钾)熔化后,立即用洗耳球向玻璃管内鼓入空气,可以观察到玻璃管内的钠(钾)块燃烧,且 比 的燃烧明显的剧烈。
④[思考]:你能用其它的实验方法探究钠、钾与空气中的氧气反应的剧烈程度吗?
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com