
具有一个羟基的化合物A 10g,与乙酸反应生成乙酸某酯11.57g,还回收了未反应的A 1.8g,则A的相对分子质量与下列数值中最接近的是( )
A.88 B.102
C.116 D.196
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
由两种烃组成的混合气体2 L与足量的氧气充分反应后生成CO2 5 L、H2O 6 L(所有体积都在120℃测定),则这两种混合气体的不可能组成是 ( )
A.CH4、C4H8 B.C2H4、C4H10 C.C2H4、C3H8 D.C2H6、C4H6
查看答案和解析>>
科目:高中化学 来源: 题型:
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是__________。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:
在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐;平衡后加热至700℃,反应逆向
进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是:
。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
 反应A:
反应A:
已知:

反应Ⅰ中反应物总键能 生成物总键能。(填大于、等于或小于)
反应Ⅱ是_________反应。(填“吸热”或“放热”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量 之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
之间关系如图所示。则该溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为
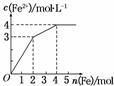 ( )
( )
A.3∶1 B.1∶2
C.2∶1 D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO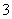 能氧化Ag。
能氧化Ag。
[设计实验方案,验证假设]
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
________________________________________________________________________。
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO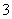 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② …… | 若银镜消失,假设2成立若银镜不消失,假设2不成立 |
[思考与交流]
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO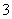 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一元有机羧酸的铵盐7.7g,与足量的碱石灰混合后共热,收集到氨气(标准状况下)的体积为2.24L,则形成此盐的有机羧酸的结构简式为( )
A.CH3COOH
B.CH3CH2COOH
C.HCOOH
D.CH3CH2CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于合金性质的说法中,错误的是( )
A.合金的硬度一般比其各成分金属的硬度高
B.合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的物理性质不同
D.合金的化学性质一般与其各成分金属的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,有一种细菌在氧气存在下的酸性溶液中,能将黄铜矿(CuFeS2)氧化成硫酸盐。发生的反应为:
4CuFeS2+2H2SO4+17O2===4CuSO4+2Fe2(SO4)3+2H2O
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是________,检验反应后溶液中含有Fe3+的方法_______________________________________________________
________________________________________________________________________。
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4·5H2O):
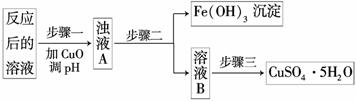
 已知Fe(OH3)、Cu(OH)2的溶度积Ksp分别为:2.6×10-39、2.2×10-20,请解释加入CuO能除去CuSO4溶液中Fe3+的原因________________________________________。
已知Fe(OH3)、Cu(OH)2的溶度积Ksp分别为:2.6×10-39、2.2×10-20,请解释加入CuO能除去CuSO4溶液中Fe3+的原因________________________________________。
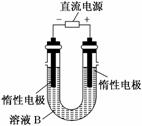
(3)有人提出可以利用如图的装置从溶液B中提炼金属铜。该过程中右侧电极的反应式是__________________________,
若将右侧电极换为铁,则铜析出在________电极上(“左侧”或“右侧”)。
(4)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)===6Cu(s)+SO2(g) ΔH=a
已知:①2Cu(s)+1/2O2(g)===Cu2O(s)
ΔH=-12 kJ·mol-1
②2Cu(s)+S(s)===Cu2S(s) ΔH=-79.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1
则a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯是来自石油的重要有机化工原料。结合以下路线回答:

已知:2CH3CHO+O2 2CH3COOH
2CH3COOH
(1)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
(2)E是有香味的物质,实验室制取E的装置如下图所示。

①反应IV的化学方程式是______________________________,
该反应类型是__________。
②该装置图中有一个明显的错误是____________________________。
(3)反应II的化学方程式是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com