
【题目】A、B、C、D、E、F代表周期表中五种短周期元素,已知:
![]() 、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
、B、C处于相邻位置,B、C同周期,A、B同主族,其核外电子数之和为41。
![]() 与C处于周期表中同一周期,
与C处于周期表中同一周期,![]() 中各层电子数都是
中各层电子数都是![]() 个。
个。
![]() 、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
、B、C、D、E各元素最外层电子数之和24,且已知E与A只能形成一种化合物。
![]() 是半径最小的原子。据此填空下列空白:
是半径最小的原子。据此填空下列空白:
![]() 写出各元素的名称A ______ C ______ E ______
写出各元素的名称A ______ C ______ E ______
![]() 写出A和D形成化合物的电子式 ______
写出A和D形成化合物的电子式 ______
![]() 、C、D三种元素单原子离子的半径由大到小的顺序: ______
、C、D三种元素单原子离子的半径由大到小的顺序: ______
![]() 、B的氢化物的熔沸点大小并写出原因: ______
、B的氢化物的熔沸点大小并写出原因: ______
![]() 写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
写出A与B组成的化合物与C单质水溶液反应的化学方程式: ______ 。
【答案】氧 氯 硅 ![]()
![]()
![]()
![]() ;水中有氢键
;水中有氢键 ![]()
【解析】
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。
由以上分析可知A为氧,C为氯,E为硅。
![]() 和D形成化合物为过氧化钠、氧化钠。
和D形成化合物为过氧化钠、氧化钠。
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小。
![]() 水中含有氢键,较一般分子间作用力强。
水中含有氢键,较一般分子间作用力强。
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl。
A、B、C、D、E代表周期表中五种短周期元素,![]() 中各层电子数都是
中各层电子数都是![]() 个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是
个,且为短周期元素,则D是Na元素,C和D处于同一周期、B和C同一周期,则B、C都位于第三周期,A和B同一主族,则A位于第二周期,A、B、C处于相邻位置,A、B、C核外电子数之和为41,设A原子序数是![]() 为正整数
为正整数![]() ,则B原子序数为
,则B原子序数为![]() ,C原子序数为为
,C原子序数为为![]() 或
或![]() ,
,![]() ,则
,则![]() 舍去
舍去![]() ,
,![]() ,
,![]() ,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数
,则A是O元素、B是S元素、C是Cl元素,A、B、C、D、E各元素最外层电子数之和24,则E最外层电子数![]() ,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
,E与A只能形成一种化合物,则E是Si元素;F是半径最小的原子,应为H元素。
![]() 由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
由以上分析可知A为氧,C为氯,E为硅。答案为:氧;氯;硅;
![]() 和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为
和D形成化合物分别为过氧化钠、氧化钠,其电子式可分别表示为![]() 、
、![]() ;
;
![]() 电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是
电子层越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,B、C、D离子分别是![]() 、
、![]() 、
、![]() ,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是
,硫离子和氯离子有3个电子层、钠离子有2个电子层,所以离子半径大小顺序是![]() 。答案为:
。答案为:![]() ;
;
![]() 水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:
水中含有氢键,较一般分子间作用力强,水的沸点较高。答案为:![]() ;水中有氢键;
;水中有氢键;
![]() 、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为
、B形成的化合物是二氧化硫,C单质是氯气,二氧化硫和氯气在水溶液中发生氧化还原反应生成硫酸和HCl,反应方程式为![]() 。答案为:
。答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知SiO2+2C![]() Si+2CO↑;Si+C
Si+2CO↑;Si+C![]() SiC。
SiC。
现有石英砂和炭粉的混合物1mol,于高温下在电炉里充分反应后,得残留固体;若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
n | 例︰n= | __ | __ | __ | __ |
残留固体及物质的量(摩) | Si | __ | __ | __ | __ |
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
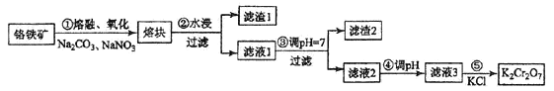
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
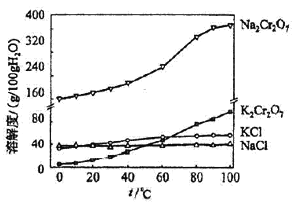
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
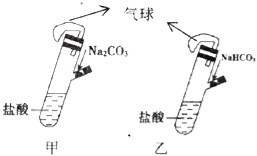
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。
(1)写出实验室制取氯气反应的化学方程式________________________。
(2)资料显示:![]()
![]()
![]() 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
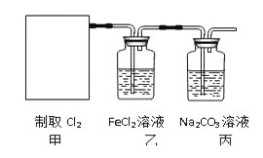
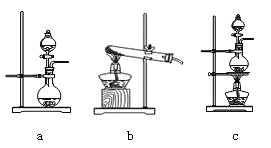
![]() 在该实验中,甲部分的装置是_______
在该实验中,甲部分的装置是_______![]() 填字母
填字母![]() 。
。
![]() 乙装置中
乙装置中![]() 溶液与
溶液与![]() 反应的离子方程式是________________。
反应的离子方程式是________________。
![]() 已知酸性:
已知酸性:![]() ,丙装置中通入少量
,丙装置中通入少量![]() ,可制得具有漂白、消毒的物质,这种物质是_______
,可制得具有漂白、消毒的物质,这种物质是_______![]() 化学式
化学式![]() 。
。
![]() 有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“
有人认为该实验存在明显的缺陷,如何改进:______________,请你写出Cl2和“![]() ”中“最合适的化学试剂”反应的离子方程式_________________________。
”中“最合适的化学试剂”反应的离子方程式_________________________。
(3)家庭中常用消毒液![]() 主要成分
主要成分![]() 与洁厕灵
与洁厕灵![]() 主要成分盐酸
主要成分盐酸![]() 清洁卫生。某品牌消毒液包装上说明如下图。
清洁卫生。某品牌消毒液包装上说明如下图。

![]() “与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:__________。
![]() 漂粉精
漂粉精![]() 主要成分
主要成分![]() 与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
与消毒液有相同的消毒功效,也需“密封保存”,请用化学方程式解释漂粉精因保存不当而变质失效的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
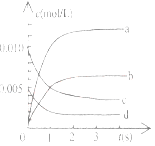
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
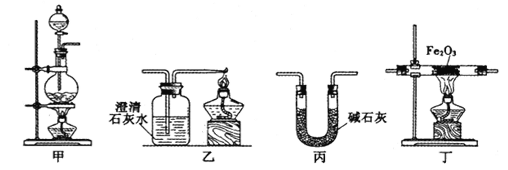
(1)装置甲中发生的反应为:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→(_____)→(_____)→(_____)
(3)丙装置中碱石灰的作用是__________________________。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____、____。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________;iii.___________。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)
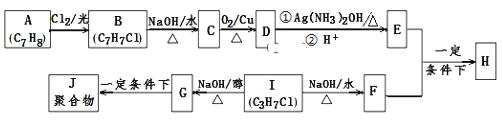
已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com