
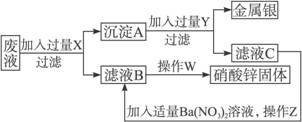
(1)X、Y分别是X___________,Y___________。(写出化学式,下同)
(2)沉淀A,滤液B、C的主要成分是A___________,B___________,C___________。
(3)操作Z的名称是,用到的主要仪器是__________________。这一操作成败的标志是_________________________________。如果失败应补救的措施是______________________。
(4)W处进行的操作是_________________________________。
解析:这是一个分离提纯的综合应用题。要从混合物Zn(NO3)2与AgNO3中分离出Ag和Zn(NO3)2,显然要对AgNO3进行化学处理。要得到Zn(NO3)2,加入的置换金属X应该是Zn,才能不引入其他杂质,造成分离麻烦。
要使AgNO3充分反应就要加入过量的Zn,所以过滤出来的沉淀A是Ag与Zn的混合物。新引入的杂质Zn要设法除去。根据要得到Zn(NO3)2的要求加入硝酸溶解过量的锌最好。但是Ag也能跟HNO3反应,所以不能加入硝酸,可以加入盐酸,引入的Cl-可以加入AgNO3除去。但是题目加入的是Ba(NO3)2溶液,可知Y是过量的H2SO4溶液。
操作Z应该是将滤液C中的杂质![]() 转化为BaSO4沉淀过滤除去。过滤操作成败的关键在于滤液是否澄清。如果滤液浑浊就必须重新进行操作。
转化为BaSO4沉淀过滤除去。过滤操作成败的关键在于滤液是否澄清。如果滤液浑浊就必须重新进行操作。
操作W从溶液到固体应该用蒸发结晶的方法。
答案:(1)Zn H2SO4
(2)Ag、Zn Zn(NO3)2 ZnSO4
(3)过滤 漏斗、玻璃棒、烧杯、铁架台 滤液是否澄清 重新过滤
(4)蒸发结晶


 名题金卷系列答案
名题金卷系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com