
(13分)氮及其化合物在生产、生活和科技等方面有重要的应用,请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着 个![]() 键和 个
键和 个![]() 键;
键;
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”、“小于”或“等于”)
①氮原子的第一电离能 氧原子的第一电离能;
②N2分子中氮氮键的键长 白磷分子中磷磷键的键长;
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述其原因是 ;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为 。
科目:高中化学 来源: 题型:
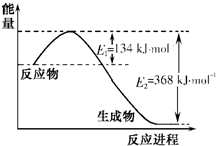 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:| t/K | 298 | 398 | 498 | … |
| K/ | 4.1×106 | K1 | K2 | … |
 N2(g)+3H2(g)的化学平衡常数的值为
N2(g)+3H2(g)的化学平衡常数的值为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2NH3(g)
2NH3(g)| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+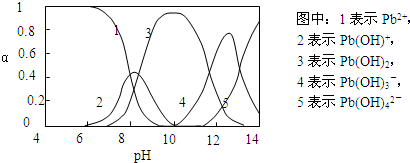
查看答案和解析>>
科目:高中化学 来源: 题型:
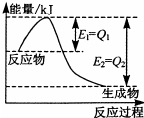 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com