
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1、+7 | -3、+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
请完成下列问题:
(1)W在周期表中的位置是___,X与P形成的化合物的电子式___。
(2)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(3)Z与Q两元素的最高价氧化物水化物之间发生反应的离子方程式为___。
(4)Y与R相比,非金属性较强的是___(用元素符号表示),根据下列方法能证明这一结论的是___(填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.R、Y的氢化物稳定性不同
.Y与R形成的化合物中的化合价
D.R、Y的氧化物的水化物的酸性强弱
(5)用电子式表示由Z和R组成的化合物的形成过程___。
(6)如图为X2和R2燃烧反应的能量变化示意图,请根据此图写出该反应的热化学方程式为___(用物质化学式表示)。
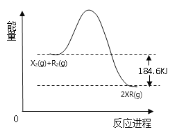
【答案】第2周期VIA ![]() 同位素 OH-+Al(OH)3═AlO2-+2H2O Cl BC
同位素 OH-+Al(OH)3═AlO2-+2H2O Cl BC ![]() H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1
【解析】
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素。
X、Y、Z、W、R、P、Q是短周期主族元素,X阳离子核外无电子,则X为H元素;Y的化合价主要为-4,+4,是无机非金属材料的主角,则Y为Si元素;Z焰色反应呈黄色,则Z为Na元素;R的主要化合价为-1,+7,则R为Cl元素;W有-2价,处于VIA族,原子半径小于Cl,故W为O元素;Q主要化合价为+3价,原子半径Na>Q>Cl,则Q为Al元素;P有-3、+5价,处于VA族,原子半径小于Cl,故P为N元素;
(1)W为氧元素,核电荷数为8,其在周期表中的位置是第2周期第VIA族,H与N形成的化合物NH3是共价化合物,含3个N-H键,其电子式为![]() ;
;
(2)R为Cl元素,自然界中有质量数为35和37的两种核素,中子数不同,二者互为同位素;
(3)Z为Na元素,最高价氧化物水化物为NaOH;Q为Al元素,最高价氧化物水化物为Al(OH)3,两者之间发生反应的离子方程式为OH-+Al(OH)3═AlO2-+2H2O;
(4)Y为Si元素,R为Cl元素,为同周期主族元素,核电荷数大,非金属性强,即Cl元素非金属性比Si强;
A.单质的状态属于物理性质,不能说明元素的非金属性强弱,故A错误;
B.非金属越强,氢化物越稳定,稳定性HCl>SiH4,说明Cl的非金属性强,故B正确;
C.Y与R形成的化合物SiCl4中Si呈+4价,说明Cl吸引电子能力强,Cl的非金属性强,故C正确;
D.利用元素最高价氧化物的水化物的酸性强弱,可比较元素非金属性强弱,未指明是最高价氧化物,故D错误;
故答案为BC;
(5)Z为Na元素,R为Cl元素,两元素组成的化合物NaCl为离子化合物,其形成过程可表示为![]() ;
;
(6)1molH2在1molCl2中燃烧生成2molHCl气体,由能量变化示意图可知△H=-184.6kJ·mol-1,则反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ·mol-1。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
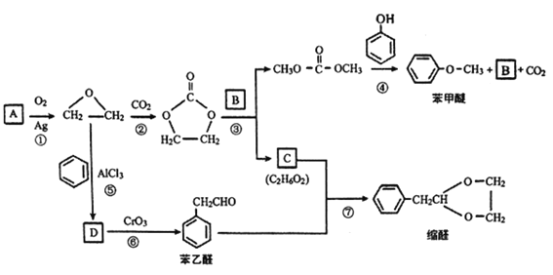
已知: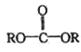 +
+![]() →2ROH+
→2ROH+
回答下列问题:
(1) B的分子式是__________ 。若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为__________。
(2) C中含有的官能团名称是_______________。⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:___________________________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:______________________。
i .含有苯环和![]() 结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备
的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备 的合成流程图:_____________________________。
的合成流程图:_____________________________。
合成流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式错误的是
A.![]() 与盐酸反应:
与盐酸反应:![]()
B.![]() 溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
溶于过量NaOH溶液: Al2O3+2OH-=2AlO2-+H2O
C.铝溶于氢氧化钠溶液: 2Al+2OH-+2H2O=2AlO2-+3H2↑
D.![]() 溶于NaOH溶液:
溶于NaOH溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
![]()
![]()
![]()
![]()
![]()
(1)若A是一种金属,C是淡黄色固体,则B的化学式为________________,A→C反应的化学方程式为________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_______,B→C反应的化学方程式为____________________________。A和C是否能反应?______(填“能”或“不能”),若能,写出反应的化学方程式:____________________(若不能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略)在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。实验现象:试管①中加热一段时间后,可以看到试管内液体沸腾;试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
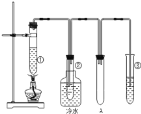
(1)装置A的作用是________
(2)试管①中发生的主要反应有:C8H18![]() C4H10+C4H8 C8H36
C4H10+C4H8 C8H36 ![]() C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
C8H18+C9H18丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为________和________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为________(填字母,答案可能不止一个,下同)
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)写出试管③中反应的任意一个化学方程式________________。
(4)试管②中的少量液体的组成是________(填序号)
①甲烷 ②乙烯 ③液态烷烃 ④液态烯烃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(CuFeS2)、FeCl3和乳酸[CH3CH(OH)COOH]为原料可制备有机合成催化剂CuCl和补铁剂乳酸亚铁{[CH3CH(OH)COO]2Fe}。其主要实验流程如下:
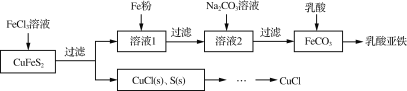
(1) FeCl3溶液与黄铜矿发生反应的离子方程式为___________________________________________。
(2)向溶液1中加入过量铁粉的目的是_______________________________________________。
(3)过滤后得到的FeCO3固体应进行洗涤,检验洗涤已完全的方法是__________________________。
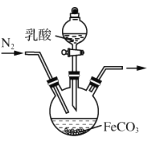
(4)实验室制备乳酸亚铁的装置如图所示。
①实验前通入N2的目的是_______________________________________。
②某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果测得产品的质量分数总是大于100%,其原因可能是_______________________________________________。
(5)已知:
①CuCl为白色晶体,难溶于水和乙醇,在空气中易氧化;可与NaCl溶液反应,生成易溶于水的NaCuCl2。
②NaCuCl2可水解生成CuCl,温度、pH对CuCl产率的影响如图所示。
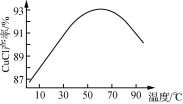
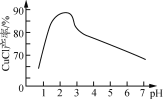
由CuCl(s)、S(s)混合物提纯CuCl的实验方案为:将一定量的混合物溶于饱和NaCl溶液中,________________________________________________________________________。(实验中须使用的试剂有:饱和NaCl溶液,0.1 mol·L-1 H2SO4、乙醇;除常用仪器外须使用的仪器有:真空干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A. 放电时负极附近溶液的碱性不变
B. 充电过程是化学能转化为电能的过程
C. 充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。已知:①C3H8(g) = CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1②C3H6(g) = CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1则相同条件下,反应C3H8(g) = C3H6(g)+H2(g)的ΔH=______________ kJ·mol-1。
(2)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224ml CO2(标准状况)和0.36g液态水,并放出8.903KJ的热量,请写出:CNG完全燃烧的热化学方程式 ____________________________________________________________
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:______________________________________________
(4) 醋酸在水溶液中的电离方程式为___________________________________________
(5) 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
A. 滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com