
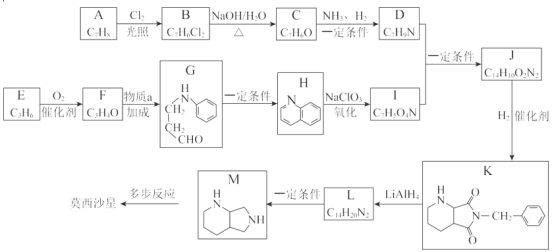
【题目】莫西沙星主要用于治疗呼吸道感染,合成路线如下:
已知: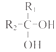
![]()
![]() +H2O
+H2O
(1)A 的结构简式是__。
(2)A→B 的反应类型是__。
(3)C 中含有的官能团是__。
(4)物质 a 的分子式为 C6H7N,其分子中有__种不同化学环境的氢原子。
(5) I 能与 NaHCO3 反应生成 CO2,D+I→J 的化学方程式是__。
(6) 芳香化合物 L 的结构简式是__。
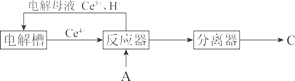
(7)还可用 A 为原料,经如下间接电化学氧化工艺流程合成 C,反应器中生成 C 的离子方程式是__。
【答案】![]() 取代反应 醛基 4
取代反应 醛基 4 
![]()
【解析】
由有机物的转化关系可知,![]() 在光照条件下与氯气发生取代反应生成
在光照条件下与氯气发生取代反应生成![]() ,则A为
,则A为![]() ,B为
,B为![]() ;
;![]() 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成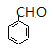 ,则C为
,则C为 ;一定条件下,
;一定条件下, 与氨气和氢气反应生成
与氨气和氢气反应生成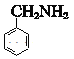 ,则D为
,则D为 ;在催化剂作用下,CH2=CHCH3与氧气发生催化氧化反应生成CH2=CHCHO,则E为CH2=CHCH3,F为CH2=CHCHO;CH2=CHCHO与
;在催化剂作用下,CH2=CHCH3与氧气发生催化氧化反应生成CH2=CHCHO,则E为CH2=CHCH3,F为CH2=CHCHO;CH2=CHCHO与![]() 发生加成反应生成
发生加成反应生成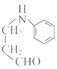 ,则a为
,则a为![]() ;
; 一定条件下转化为
一定条件下转化为![]() ,
,![]() 与氯酸钠发生氧化反应生成
与氯酸钠发生氧化反应生成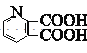 ,则I为
,则I为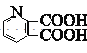 ;一定条件下,
;一定条件下,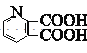 与
与 发生取代反应生成
发生取代反应生成 ,则J为
,则J为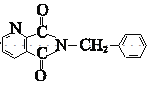 ;在催化剂作用下,
;在催化剂作用下, 与氢气发生加成反应(或还原反应)生成
与氢气发生加成反应(或还原反应)生成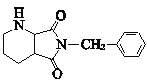 ,
, 与LiAlH4发生还原反应生成
与LiAlH4发生还原反应生成![]() ,则L为
,则L为![]() ;
;![]() 一定条件下转化为
一定条件下转化为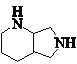 ,
, 经过一系列反应生成莫西沙星。
经过一系列反应生成莫西沙星。
(1)由分析可知,A的结构简式是![]() ,故答案为:
,故答案为:![]() ;
;
(2)A→B 的反应为,![]() 在光照条件下与氯气发生取代反应生成
在光照条件下与氯气发生取代反应生成![]() ,故答案为:取代反应;
,故答案为:取代反应;
(3)C的结构简式为 ,官能团醛基,故答案为:醛基;
,官能团醛基,故答案为:醛基;
(4)物质 a 的分子式为C6H7N,结构简式为![]() ,分子中有4种不同化学环境的氢原子,故答案为:4;
,分子中有4种不同化学环境的氢原子,故答案为:4;
(5)I的结构简式为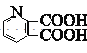 ,D+I→J 的反应为一定条件下,
,D+I→J 的反应为一定条件下,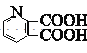 与
与 发生取代反应生成
发生取代反应生成 和水,反应的化学方程式为
和水,反应的化学方程式为 ,故答案为:
,故答案为: ;
;
(6)由分析可知,芳香化合物 L 的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(7)酸性条件下,反应器中![]() 与Ce4+离子发生氧化反应生成
与Ce4+离子发生氧化反应生成 和Ce3+离子,反应的离子方程式为
和Ce3+离子,反应的离子方程式为 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】0.2mol某烃A在氧气中充分燃烧后,生成物B、C各为1.2mol。
(1)烃A的分子式为 ________。
(2)①若烃A不能因发生反应使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则烃A的结构简式为 __________。
②若烃A能使溴水褪色,在催化剂作用下可与H2加成,其加成产物分子中含有4个甲基,则所有符合条件的烃A的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
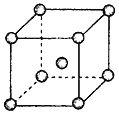
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物浸出是用细菌等微生物从固体中浸出金属离子,有速率快、浸出率高等特点。氧化亚铁硫杆菌是一类在酸性环境中加速 Fe2+氧化的细菌,培养后能提供 Fe3+, 控制反应条件可达细菌的最大活性,其生物浸矿机理如下图。
![]()
反应1 反应2
(1)氧化亚铁硫杆菌生物浸出 ZnS 矿。
①反应 2 中有 S 单质生成,离子方程式是__。
② 实验表明温度较高或酸性过强时金属离子的浸出率均偏低,原因可能是__。
(2)氧化亚铁硫杆菌生物浸出废旧锂离子电池中钴酸锂(LiCoO2)与上述浸出机理相似,发生反应1 和反应3:LiCoO2 +3Fe3+=Li++ Co2++3Fe2++O2↑
①在酸性环境中,LiCoO2 浸出 Co2+的总反应的离子方程式是__。
②研究表明氧化亚铁硫杆菌存在时,Ag+对钴浸出率有影响,实验研究 Ag+的作用。取 LiCoO2 粉末和氧化亚铁硫杆菌溶液于锥形瓶中,分别加入不同浓度 Ag+的溶液,钴浸出率(图 1)和溶液 pH(图 2)随时间变化曲线如下:
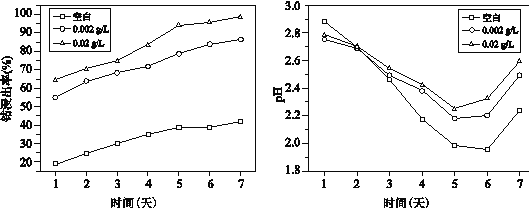
图1 不同浓度Ag+作用下钴浸出率变化曲线 图2 不同浓度Ag+作用下溶液中pH变化曲线
Ⅰ.由图 1 和其他实验可知,Ag+能催化浸出 Co2+,图 1 中的证据是__。
Ⅱ.Ag+是反应 3 的催化剂,催化过程可表示为: 反应 4:Ag++LiCoO2=AgCoO2+Li+
反应 5:……
反应 5 的离子方程式是__。
Ⅲ.由图 2 可知,第 3 天至第 7 天,加入 Ag+后的 pH 均比未加时大,结合反应解释其原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,关于该有机物,下列叙述正确的是( )
,关于该有机物,下列叙述正确的是( )
A. 所有碳原子可能处于同一平面
B. 属于芳香族化合物的同分异构体有三种
C. 能发生取代反应、氧化反应和加成反应
D. 能使溴水、酸性KMnO4溶液褪色且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )

A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)=Si(s)+ 4HCl(g)△H=QkJmol-1(Q>0)。在一定某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应,下列叙述错误的是
A.反应过程中,若充入一定量NH3,可能提高SiCl4的转化率
B.若反应开始时加入1mol SiCl4,则达到平衡时,.吸收热量小于Q kJ
C.反应至4min时,若HCl浓度为0.12 molL-l,H2的反应速率为0.03 molL-1min-1
D.当反应吸收热量为0.025QkJ时,生成的 HC1 恰好中和 0.l molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com