
| A. | 电子数 | B. | 质量 | C. | 原子数 | D. | 氮原子数 |
分析 同温同压下,体积相等的不同气体物质的量相等,根据N=nNA、m=nM结合分子构成计算.
解答 解:同温同压下,体积相等的不同气体物质的量相等,
A.N2和NO的电子数不等,所以物质的量相等的两种物质的电子数不等,故A错误;
B.由于M不同,由m=nM可知,质量不同,故B错误;
C.物质的量相等,由N=nNA可知二者分子总数相等,且两者都是双原子,所以原子数相等,故C正确;
D.物质的量相等N2和NO氮原子数之比为:2:1,所以氮原子数不等,故D错误;
故选C.
点评 本题考查了阿伏伽德罗定律及其推论,明确分子构成、物质的量基本公式即可解答,熟练掌握物质的量公式中各个物理量的关系并灵活运用,题目难度不大.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化分子的能量不变 | B. | 增加了活化分子的百分数 | ||
| C. | 降低了反应的活化能 | D. | 改变了化学反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
| 3 | 加入足量BaCl2溶液,将所得沉淀洗涤、干燥、称重;再向沉淀中加足量的稀盐酸,洗涤、干燥、称重 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO2)=4mol•L-1•min-1 | B. | v(O2)=3mol•L-1•min-1 | ||
| C. | v(SO2)=0.1mol•L-1•s-1 | D. | v(O2)=0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.5 mol/L | C. | 2 mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
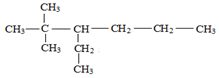 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.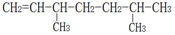 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.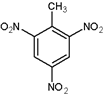 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com