
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
|
| A. | 标准状况时,22.4L四氯化碳所含有的分子数为NA |
|
| B. | 34g H2O2中含有的非极性共价键数为 NA |
|
| C. | 碱性锌锰电池中,当有1.3g的锌消耗,则转移的电子数为0.002NA |
|
| D. | 将16gO2与64gSO2在一定的条件下充分反应生成的SO3分子数为NA |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A、标准状况时,四氯化碳不是气体;
B、一个H2O2中含有1个非极性共价键,34g H2O2的物质的量为1mol;
C、根据锌的物质的量和化合价变化分析;
D、二氧化硫与氧气的反应为可逆反应.
解答:
解:A、标准状况时,四氯化碳不是气体,不能带入n=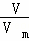 计算,故A错误;
计算,故A错误;
B、34g H2O2的物质的量为1mol,分子数为 NA,而一个H2O2中含有1个非极性共价键,故B正确;
C、1个Zn原子失去两个电子,1.3g锌的物质的量为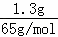 =0.02mol,因此转移的电子数为2×0.02×NA=0.04NA,故C错误;
=0.02mol,因此转移的电子数为2×0.02×NA=0.04NA,故C错误;
D、二氧化硫与氧气的反应为可逆反应,不能进行到底,不知反应限度,无法计算SO3分子数,故D错误;
故选B.
点评:
本题考查物质的量的相关计算,侧重于学生的分析和计算能力的考查,为高频考点,解答本题时要注意物质的存在的条件以及状态,答题时不能忽视,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于热化学的说法正确的是( )
|
| A. | 需要加热才能发生的反应是吸热反应 |
|
| B. | 等量的金刚石和石墨固体分别完全燃烧,前者放出热量多,说明金刚石更稳定 |
|
| C. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
|
| D. | 由热化学方程式 3H2(g)+N2(g)⇌2NH3(g)△H=﹣92 kJ/mol可知,1molN2与3molH2放入密闭容器中,在催化剂的作用下反应得到氨气,将释放92kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
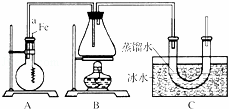
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
(1)写出制取溴苯的化学方程式: .
(2)步骤③中观察到的现象是: .
(3)C装置中U形管内部用蒸馏水封住管底的作用是: .
(4)反应完毕后,U形管内的现象是: .分离溴乙烷时所用的最主要仪器的名称是(只填一种) .
(5)实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有 (填化学式).欲得到无色的溴苯的方法是 (填试剂和操作名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)图1为元素X的前五级电离能的数值示意基态图,已知X的原子序数小于20,请写出X基态原子的核外电子排布式
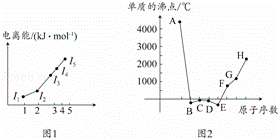
(2)A、B、C、D、E、F、G、H八种连续短周期元素,其单质的沸点如图2所示.请回答:
①上述元素中,某些元素的常见单质所形成的分子中既含有σ键又含有π键的是 (填化学式).
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) .
③B元素与D元素形成的化合物的电子式为 ,价层电子对互斥模型为 ,中心原子的杂化方式为 .
④已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华.据此推测该化合物的化学键类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;②向上述稀硫酸中插入铜片,没有看到有气泡生成;③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转.下列关于以上实验设计及现象的分析,不正确的是( )
|
| A. | 实验①、②说明锌能与稀硫酸反应而铜不能 |
|
| B. | 实验③说明发生原电池反应时会加快化学反应速率 |
|
| C. | 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
|
| D. | 实验④说明该原电池中铜为正极、锌为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.08mol•L﹣1,则下列判断正确的是( )
|
| A. | C1:C2=1:3 |
|
| B. | 平衡时,H2和NH3的生成速率之比为2:3 |
|
| C. | N2、H2的转化率之比为1:3 |
|
| D. | C1的取值范围为0.04mol•L﹣1<Cl<0.14mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验处理不可行的是( )
①将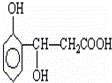 与NaOH的醇溶液共热制备CH3﹣CH═CH2
与NaOH的醇溶液共热制备CH3﹣CH═CH2
②向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热﹣﹣检验混合物中是否含有甲醛
③向丙烯醛(CH2=CH﹣CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
④为验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再滴入几滴硝酸银溶液,观察现象.
|
| A. | 只有①③ | B. | 只有①②④ | C. | 只有②③④ | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中正确的是( )
①46g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥0.lmol·L-1Na2CO3溶液中含有0.1NA个CO32-
⑦1 mol Na2O2与水完全反应时转移电子数为2NA
A. ③⑤⑥ B.①②③⑤ C.①②⑤ D. ①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com