
| A、16g氧气和臭氧的混合物中原子的数目0.5NA |
| B、1mol Cl2与足量的铁完全反应,转移的电子数为2NA |
| C、1 L 0.5mol?L-1 AlCl3溶液中含有的Al3+数目为0.5NA |
| D、在标准状况下,22.4L HCl与22.4L H2O2所含有的电子数均为18 NA |
| m |
| M |
| 16g |
| 16g/mol |


科目:高中化学 来源: 题型:
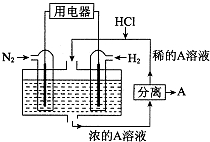 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B元素组成的一种单质具有漂白性,能使KMnO4溶液紫色褪去 |
| B、B、D两种元素形成的一种化合物也具有一定的漂白性,能使紫色石蕊紫色褪去 |
| C、C元素分别与A元素和B元素形成的化合物都是离子晶体,一定均与水反应生成强碱和无色气体 |
| D、A2B的热稳定性强于A2D、沸点也高于A2D,但解释的理由不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHSO4溶液中加入过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B、向Fe(OH)3中加入过量的HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、用淀粉碘化钾试纸和盐酸检验加碘盐:IO3-+5I-+6H+=3I2+3H2O |
| D、将少量SO2气体通入足量的NaClO溶液中:SO2+ClO-+H2O=SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2中含4NA个离子 |
| B、常温常压下,46gNO2和N2O4混合物含有原子数为3NA |
| C、标准状况下,22.4LCHCl3中含有的氯原子数为3NA |
| D、18gD2O中含有的质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在使用过程中,电池负极区溶液的pH减小 |
| B、使用过程中,电子由Ag20极经外电路流向Zn极 |
| C、Zn是正极,Ag2O是负极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、维生素在天然食品中含量丰富,所以加工后的食品中维生素含量也高 |
| B、人体细胞中的酸碱平衡是不能通过选择食物调节的 |
| C、为了食品安全,我国应该禁止使用食品防腐剂 |
| D、食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
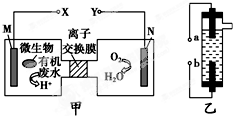 甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能.乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水.下列说法中不正确的是( )| A、装置乙的a极要与装置甲的X极连接 |
| B、装置乙中b极的电极反应式为2Cl--2e-═Cl2↑ |
| C、若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、N电极发生还原反应,当N电极消耗5.6 L气体(标准状况下)时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或反应 | 原理解释 | |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面生成的氧化物具有高熔点 |
| B | 钠和氧气在加热条件下进行反应 | 该反应为吸热反应 |
| C | 碳酸钠和氢氧化钠溶液中滴加酚酞,溶液都呈红色 | 碳酸钠和氢氧化钠都是碱 |
| D | 铁制容器可用于盛装冷的浓硫酸 | 铁与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com