
分析 (1)温度较高时分子间作用力减弱,影响溶解了的“碘分子”与溶剂分子的结合程度;
(2)水晶是晶体,在导热性中体现了各向异性,玻璃是非晶体,不具有各向异性.
解答 解:(1)温度较高时分子间作用力减弱,溶解了的“碘分子”与溶剂分子的结合程度减小,则溶液颜色较深,反之较深,所以温度较高时,溶液颜色为紫色,温度较低时,溶液颜色为棕色,
故答案为:棕色;紫色;温度高时,分子间作用力弱;
(2)水晶是晶体,在导热性中体现了各向异性,水晶柱面不同方向的导热性不同,故融化的石蜡呈椭圆形,而玻璃是非晶体,不具有各向异性,玻璃的各个方向的导热性都是相同的,故熔化的石蜡呈圆形.
故答案为:这是因为水晶是晶体,在导热性中体现了各向异性,即水晶柱面不同方向的导热性不同,故融化的石蜡呈椭圆形,而玻璃是非晶体,不具有各向异性,玻璃的各个方向的导热性都是相同的,故熔化的石蜡呈圆形.
点评 本题综合考查晶体的类型和性质,为高频考点,侧重于学生的分析能力的考查,涉及氢键、物质的溶解性以及晶体的性质,题目难度中等,注意影响分子性质的因素.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
 单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化/KJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 放出热量:Q2 |
| A. | 两容器中反应的平衡常数不相等 | |
| B. | 达到平衡时SO2的体积分数:甲<乙 | |
| C. | 197>Q1>Q2 | |
| D. | 生成1molSO3(l)时放出的热量等于98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

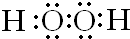 ,C元素在周期表中的位置是第二周期、第ⅦA族.
,C元素在周期表中的位置是第二周期、第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
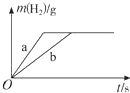
| A. | 曲线a为K,b为Na | |
| B. | 稀盐酸一定不足量 | |
| C. | 投入Na、K一定等质量 | |
| D. | 投入Na的物质的量小于K的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com