
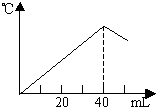
 运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )
运用中和热的测定方法,在绝对保温、隔热的条件下,向20mL2.08mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是( )| A、2.08mol/L | B、1.04mol/L | C、4.16mol/L | D、0.52mol/L |
| n |
| V |
| 1 |
| 2 |
| 0.020L×2.08mol/L |
| 2 |
| 0.0208mol |
| 0.040L |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:物理教研室 题型:013
A.20.8mol/L B.4.16mol/L C.6.9mol/L D.5.2mol/L
查看答案和解析>>
科目:高中化学 来源:浙江省滨江高中2008-2009学年高二五月综合测试化学试卷 题型:021
|
运用中和热的测定方法,在绝对保温、隔热的条件下,向20 mL 2.08 mol/L的NaOH溶液中逐滴加入未知浓度的H2SO4(边加边充分搅拌)后,测得溶液的温度与滴加H2SO4溶液体积关系如图所示,则该H2SO4溶液的物质的量浓度约是
| |
A. |
2.08 mol/L |
B. |
1.04 mol/L |
C. |
4.16 mol/L |
D. |
0.52 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
C.6.9 mol·L-1 D.5.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
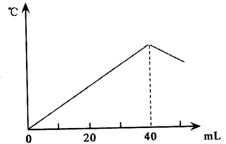
A.2.08 mol·L-1 B.1.04 mol·L-1
C.4.16 mol·L-1 D.0.52 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com