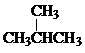解答:
解:(1)SO
2先与V
2O
5反应生成V
2O
4,V
2O
5参与反应作氧化剂,本身被还原为V
2O
4则二氧化硫被氧化为三氧化硫,
故答案为:SO
2+V
2O
5?V
2O
4+SO
3;
(2)2SO
2(g)+O
2(g)?2SO
3(g)△H=-196.6kJ?mol
-1,说明反应是气体体积减小的放热反应,则
A.c(SO
2)=c(SO
3)的状态,SO
2和SO
3浓度相等,无法判断正逆反应速率是否相等,故A错误;
B.混合气体质量不变,气体物质的量变化,当混合气体平均分子量保持不变的状态,说明反应达到平衡状态,故B正确;
C.单位时间生成2n mol的SO
2同时生成n mol的O
2的状态,是指反应逆向进行,不能说明费用达到平衡状态,故C错误;
D.V(SO
2)
正=2V(O
2)
逆的状态,说明压强正逆反应速率相同,证明反应达到平衡状态,故D正确;
故答案为:BD.
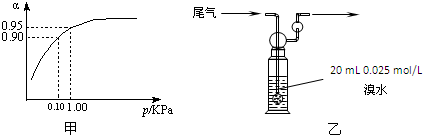
(3)当压强为0.1KPa时,SO
2的转化率为0.90,SO
2的转化率已很高,当压强为1.0KPa时,SO
2的转化率为0.95;
此时,对设备、能源都有很高的要求,压强的增加引起SO
2转化率的变化并不明显,经济上不划算,
故答案为:在常压时,SO
2的转化率已很高,若加压,则对设备、能源等有较高的要求,经济上不划算;
(4)设反应的二氧化硫为x,则
2SO
2(g)+O
2(g)?2SO
3(g),△H=-196.6kJ?mol
-12mol 196.6kJ
x 353.6kJ
=
,解得x=3.6mol,
所以SO
2的转化率为
×100%=90%,
故选:D;
(5)根据反应SO
2+I
2+2H
2O═H
2SO
4+2HI,n(SO
2)=n(I
2)=20×10
-3 L×0.025 mol/L=0.0005 mol,V(SO
2)=0.0005 mol×22.4 L/mol=0.0112 L
V(SO
2)%=
×100%=0.1%,
故答案为:0.1%;
(6)在温度相同、体积均为1L的三个密闭容器中,SO
3的物质的量均为1mol.化学平衡状态的达到与化学反应途径无关.在相同的条件下,可逆反应,无论从正反应开始还是从逆反应开始,还是从既有反应物又有生成物开始,达到的化学平衡状态是相同的,平衡混合物中各组成物质的百分含量保持不变,就是等效平衡.三个密闭容器,保持恒温、恒容,最终c(SO
3)=1.4 mol?L
-1.三个容器中的反应为等效平衡.体积均为1L,最终n(SO
3)=1.4 mol.
甲 2SO
2(g)+O
2(g)?2SO
3(g);△H=-196.6kJ?mol
-1.
起始量(mol) 2 1 0
变化量 (mol) 1.4 0.7 1.4 196.6kJ×
=137.62KJ
平衡量 (mol) 0.6 0.3
故a=137.62,α
1=
=0.7,
乙容器保持恒温、恒容,和甲容器中反应为等效平衡.故b=196.6kJ×(2-1.4)×
=58.98kJ.该反应从三氧化硫开始,α
2=
=0.3,α
1+α
2=0.7+0.3=1.
丙 2SO
2(g)+O
2(g)?2SO
3(g);△H=-196.6kJ?mol
-1.吸收ckJ说明反应从逆反应方向开始.
起始量(mol) m n p
变化量 (mol) 0.2 0.1 1.4÷(1-12.5%)-1.4
平衡量 (mol) m+0.2 n+0.1 1.4
P=1.4÷(1-12.5%)=1.6,c=196.6kJ×(1.6-1.4)×
=19.66KJ
b+c=58.98KJ+19.66KJ=78.64kJ,
故答案为:1;1.6;78.64.



 考前必练系列答案
考前必练系列答案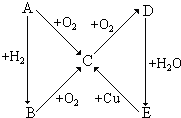 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质的化学式和有关反应的化学方程式. Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.
Ⅰ同学们已经学习了同位素、同系物、同素异形体、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.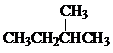 和
和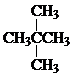
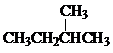 和
和