
分类法是化学学习中的一种重要方法,下列分类图正确的是( )

科目:高中化学 来源: 题型:
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
 |
⑴ 粗食盐水中含有Ca2+、Mg2+、SO 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO ,其原因是
,其原因是
。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O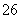 )
)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HC l(aq)=NaCl(aq)+H2O(
l(aq)=NaCl(aq)+H2O( I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全
I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全
反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| 单质及其化合物的焰色反应为黄色 | |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的 键和
键和 键的个数比是 。
键的个数比是 。
⑶Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
⑷废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+ O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质分类的依据通常是根据它的组成和性质,下列仅从组成角度对物质分类的是( )
A.硫酸钠是钠盐、硫酸盐、正盐
B.二氧化硫是氧化物、酸酐、有漂白性的物质
C.氢氧化钠是一元碱、易溶性碱、强碱
D.碳酸氢钠是钠盐、酸式盐、易分解的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe。完成下列问题。
(1)该反应中的还原产物的化学式是________,氧化产物的化学式是________。
(2)该反应的离子方程式为____________________________。
(3)标出该反应中电子转移的方向和数目_______________________________________________________。
(4)如反应转移了0.3 mol电子,则________(填“溶解”或“生成”)的铁的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
A.①③④ B.①③⑤ C.②④⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G.
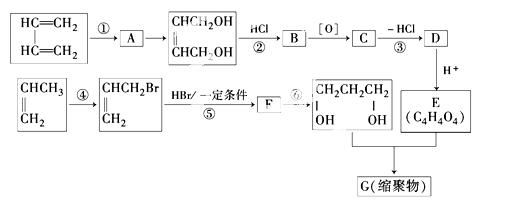
请完成下列各题:
(1)写出反应类型:反应①__________,反应④__________.
(2)写出反应条件:反应③__________,反应⑥__________.
(3)反应②③的目的是:_______________________________________________.
(4)写出反应⑤的化学方程式:_____________________________________________.
(5)B被氧化成C的过程中会有中间产物生成,中间产物可能是____________(写出一种物质的结构简式),检验该物质存在的试剂是_____________________________.
(6)写出G的结构简式________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com