
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 ===6SO2+Fe3O4,有3 mol FeS2参加反应,转移________ mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为________________;从腐蚀废液回收得到金属铜,还需要的试剂是__________________________。
(3)与明矾相似,硫酸铁也可作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________________________________________________________
________________________________________________________________________。
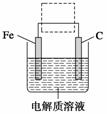
(4)钢铁的电化学腐蚀原理如图所示,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在图中虚线框内作出修改,并用箭头标出电子流动方向。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。

(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式:
。
(3)写出L→M的化学方程式:
。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件下,离子能大量共存或者离子方程式正确的是
A.pH=1的溶液中:Fe2+、ClO-、Na+、SO42-
B.在含较多Al3+的溶液中:K+、Cl-、HCO3-
C.NH4HSO4溶液与过量NaOH稀溶液反应:NH4+ +OH-=NH3·H2O
D.向小苏打溶液中加入NaOH固体:HCO3- + OH-= CO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲探究食品添加剂铵明矾NH4Al(SO4)2·12H2O高温分解的情况。
(1)预测产物:下列关于气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)定性检验:取一定量铵明矾,设计下列实验探究产物。
①按图示组装仪器后,首先检查整套装置的气密性,操作是 。
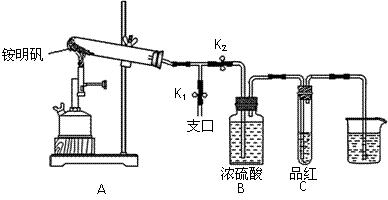 |
②夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是 ;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是 (任填一种物质的化学式)。
③分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式 。
④为了防止倒吸,实验结束时必须先 (填字母序号),然后熄灭酒精喷灯。
A.取出烧杯中的导管 B.打开止水夹K1 C.关闭止水夹K2
(3)分析和结论:实验证明气体产物是(1)D中的5种气体。相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.热固性塑料受热后易熔化 B.抗酸药具有抗菌、抗生作用
C.蛋白质、油脂都能发生水解反应
D.工业废水中的重金属离子可用混凝剂除去.
查看答案和解析>>
科目:高中化学 来源: 题型:
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X的性质的描述中正确的是
A.X单质易与水反应 B.X形成的氧化物易与水反应生成酸
C.X易形成氧化物XO D.XH4的稳定性比SiH4的低
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于________族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是________(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是________(填序号)。
a.自然界中的含量 b. 单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d. 最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因: ,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是____________________________________________________
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有______________(填序号)。
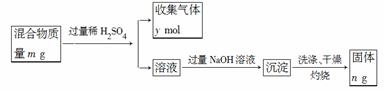
a.m、n b.m、y c.n、y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com