
| A. | 80g CuO和Cu2S的混合物含有铜原子数一定为NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| D. | 向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为NA |
分析 A.CuO和Cu2S中铜元素的质量分数相等,都是80%;
B.由于粗铜中含有活泼性较强的铁、锌等杂质,所以阳极溶解的铜的质量小于32g;
C.氯气与铁反应生成氯化铁,依据量少的计算转移电子数;
D.碘离子的还原性强于二价铁离子,氯气先氧化碘离子,再氧化二价铁离子.
解答 解:A.80gCuO和Cu2S的混合物中含有铜元素的质量为:80g×$\frac{64}{80}$=64g,含有的铜的物质的量为1mol,含有铜原子数一定为NA,故A正确;
B.电解精炼铜时,粗铜中含有较活泼的杂质铁、锌,电解过程中铁、锌先放电,所以当电路中转移NA个电子,即1mol电子,阳极溶解的铜的物质的量小于0.5mol,质量小于32g,故B错误;
C.1mol铁与1molCl2充分反应生成氯化铁,氯气完全反应铁不足,依据氯气的量计算转移电子为2mol,转移电子数为2NA个,故C错误;
D.向含有FeI2的溶液中通入适量氯气,氯气先氧化I-,当有1mol Fe2+被氧化时转移NA个电子;2mol I-被氧化时转移2NA个电子;该反应转移电子的数目至少为3NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,明确物质的构成、发生的氧化还原反应、转移的电子数是解题关键,注意二价铁离子与碘离子的还原性强弱.


科目:高中化学 来源: 题型:选择题
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
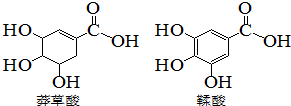 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com