
 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图转化关系:

科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
| A、CN-+H2O+CO2═HCN+HCO3- |
| B、0.1mol?L-1 HCOONa溶液比0.1mol?L-1 NaCN溶液的pH大 |
| C、用0.1mol?L-1 NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大 |
| D、0.1mol?L-1 NaHCO3溶液中粒子浓度的大小:c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:
元素周期表是学习化学的一种重要工具.A、B、C、D、E、F是周期表中前四周期的六种元素,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F有+1、+2两种常见的化合价,其单质为红色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
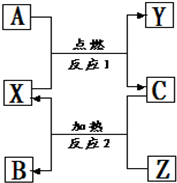 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法正确的是( )
如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法正确的是( )| A、分子式为C3H7NO |
| B、在一定条件下,可以生成高分子化合物 |
| C、不能和盐酸溶液反应 |
| D、不能和NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:
某研究性学习小组用0.20mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其实验探究操作为如下几步:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com