
分析 (1)据已知热化学方程式,利用盖斯定律解答;
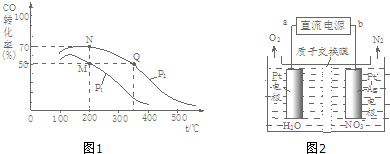
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,据此计算其物质的量之比;
相同温度下,化学平衡常数相等,据此计算两个容器体积之比;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;
(3)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水;
(4)①若将Cr2O72-转化为Cr(OH)3沉淀除去,必须将Cr从+6价还原为+3价;
②据Ksp[Fe(OH)2]1×10-15、Ksp[Cr(OH)3]=1×10-23,计算其pH.
解答 解:(1)已知①H2(g)+1/2O2(g)═H2O(g)△H1=-241.8kJ•mol-1
②C(s)+1/2O2(g)═CO(g)△H2=-110.5kJ•mol-1
据盖斯定律,②-①得:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ•mol-1;
(2)①M点时,CO转化率为50%,则参加反应的n(CO)=10mol×50%=5mol,还剩余5molCO,根据方程式知,还剩余n(H2)=20mol-5mol×2=10mol,生成n(CH3OH)=5mol;N点时,CO转化率为70%,参加反应的n(CO)=10mol×70%=7mol,还剩余3molCO,根据方程式知,还剩余n(H2)=20mol-7mol×2=6mol,生成n(CH3OH)=7mol,所以容器中总物质的物质的量之比为:n(M)总:n(N)总=(5+10+5)mol:(3+6+7)mol=5:4,故答案为:5:4;
②化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ,故答案为:KM=KN>KQ;
(3)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子,同时还生成水,所以反应方程式为2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O,故答案为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,故答案为:a;2NO3-+12H++10e-=N2+6H2O;
(4)①若将Cr2O72-转化为Cr(OH)3沉淀除去,必须将Cr从+6价还原为+3价,加入绿矾(FeSO4•7H2O)的目的是还原6价Cr,反应的离子方程式为:Cr2O72-+6 Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:Cr2O72-+6 Fe2++14H+=6Fe3++2Cr3++7H2O;
②Ksp[Fe(OH)2]1×10-15,Fe2+开始沉淀时,c(Fe2+ )=0.1mol/L,溶液的pH=7.0;完全沉淀时,c(Fe2+)=1×10-5 mol/L时,溶液的pH=9.0;
Ksp[Cr(OH)3]=1×10-23,Cr3+开始沉淀时,c(Cr 3+ )=10.0mol/L时,c(OH-)=1×10-8 mol/L,pH=6.0;完全沉淀时,c(Cr 3+ )=1×10 -5 mol/L时,溶液的pH=8.0;故二者共沉淀的pH范围是7.0~8.0,
故答案为:7.0~8.0.
点评 本题考查化学平衡及电解原理,知道化学平衡状态判断方法、温度与化学平衡常数的关系、外界条件对化学平衡的影响、电解原理等知识点分析解答即可,注意(1)③中根据化学平衡常数计算容器体积之比,注意:只有反应前后改变的物理量才能作为化学平衡状态的判断依据,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
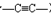 )组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )
)组成的混合气体与足量的H2反应,充分加成后,生成4.4g3种对应的烷径中一定有( )| A. | 乙炔 | B. | 乙烷 | C. | 丙炔 | D. | 丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 | |
| D. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力是决定由分子构成物质熔、沸点高低的惟一因素 | |
| B. | 范德华力与物质的性质没有必然的联系 | |
| C. | 范德华力能够影响物质的化学性质和物理性质 | |
| D. | 范德华力仅是影响物质部分物理性质的一种因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
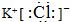 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com