
【题目】为测定某有机化合物A的结构,进行如下实验. 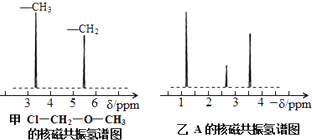
(1)分子式的确定
将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2 , 消耗氧气6.72L(标准状况下).则该物质的实验式是;
(2)质谱仪测定有机物A的相对分子质量为46,则该物质的分子式;
(3)结构式的确定
预测A的可能结构并写出结构简式 .
(4)性质实验
核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl﹣CH2﹣O﹣CH3)有两种氢原子(见图甲).经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为 .
(5)A在一定条件下脱水可生成B,B可合成用于食品包装的塑料C,请分别写出转化反应化学方程式:
A→B:;
B→C: .
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式:
【答案】
(1)C2H6O
(2)C2H6O
(3)CH3CH2OH或CH3OCH3
(4)CH3CH2OH
(5)CH3CH2OH ![]() CH2=CH2↑+H2O;nCH2=CH2
CH2=CH2↑+H2O;nCH2=CH2 ![]()
![]()
(6)nCH2=CH2 +HCl ![]() CH3CH2 Cl
CH3CH2 Cl
【解析】解:(1)由题意可知n(H2O)= ![]() =0.3mol,n(CO2)=
=0.3mol,n(CO2)= ![]() =0.2mol,n(O2)=
=0.2mol,n(O2)= ![]() =0.3mol,
=0.3mol,
根据氧原子守恒可知有机物中含有n(O)=0.3mol+0.2mol×2﹣0.3mol×2=0.1mol,
则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,则实验式为C2H6O,
所以答案是:C2H6O;(2)该物质中各元素的原子个数比为N(C):N(H):N(O)=2:6:1,则最简式为C2H6O,其相对分子质量为46,则有机物的分子式为C2H6O,
所以答案是:C2H6O;(3)有机物的分子式为C2H6O,分子中可能存在C﹣C、C﹣H、C﹣O、O﹣H等化学键,可能的结构简式有CH3CH2OH或CH3OCH3 ,
所以答案是:CH3CH2OH或CH3OCH3 . (4)有机物A分子中有三种不同化学环境的氢原子,应为乙醇,即CH3CH2OH,二甲醚只有一种不同化学环境的氢原子,
所以答案是:CH3CH2OH;(5)乙醇在一定条件下脱水可生成B,B为CH2=CH2 , B可合成包装塑料C,C为聚乙烯,反应的化学方程式分别为CH3CH2OH ![]() CH2=CH2↑+H2O、nCH2=CH2
CH2=CH2↑+H2O、nCH2=CH2 ![]()
![]() ,
,
所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;nCH2=CH2
CH2=CH2↑+H2O;nCH2=CH2 ![]()
![]() ;(6)原子利用率为100%,可用乙烯与HCl加成方法制备,反应的方程式为nCH2=CH2 +HCl
;(6)原子利用率为100%,可用乙烯与HCl加成方法制备,反应的方程式为nCH2=CH2 +HCl ![]() CH3CH2 Cl,
CH3CH2 Cl,
所以答案是:nCH2=CH2 +HCl ![]() CH3CH2 Cl.
CH3CH2 Cl.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下: 
已知:
生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 . 盐酸溶解MnCO3的化学方程式是 .
(2)向溶液1中加入双氧水时,反应的离子方程式是 .
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+ , 反应的离子方程式是 .
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为: Mn2++ClO3﹣+=++ .
(5)将MnCl2转化为MnO2的另一种方法是电解法. ①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2 . 检验Cl2的操作是 .
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2CO3和HCl反应的下列各组实验中,反应速率最快的一组是
组号 | 温度(℃) | Na2CO3浓度(mol/L) | HCl浓度(mol/L) |
A | 20 | 0.1 | 0.2 |
B | 20 | 0.2 | 0.2 |
C | 10 | 0.2 | 0.4 |
D | 20 | 0.2 | 0.4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于如图所示电化学装置的分析正确的是( ) 
A.若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B.若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C.若X为电流计,Y为锌棒,则SO42﹣ 移向Fe棒
D.若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20mL 0.01molL﹣l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( ) 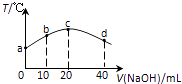
A.HNO2的电离平衡常数:c点>b点
B.b点混合溶液显酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣)
C.c点混合溶液中:c(OH﹣)>c(HNO2)
D.d点混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,指定使用的仪器必须预先干燥的是( )
A.喷泉实验中用于收集氨气的烧瓶
B.中和滴定中用的滴定管
C.配制一定物质的量浓度溶液实验用的容量瓶
D.排水法收集氧气实验用的集气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O = 2NaOH + H2↑ ②2Na2O2 + 2H2O = 4NaOH + O2↑
③Na2O + H2O =2NaOH ④2H2O![]() 2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
2H2↑+ O2↑ ⑤2F2 + 2H2O = 4HF + O2
(1)其中不属于氧化还原反应的是____________(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是___________(填编号);水只作还原
剂的反应是___________(填编号);水既作氧化剂,又作还原剂是_________(填编号);水既不作氧化剂,又不作还原剂是___________(填编号)。
(3)根据你的理解,氧化还原反应的特征是_____。
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是_________,氧化产物是________,被氧化的氮元素与被还原的氮元素的物质的量之比是______;如果3mol的NO2完全反应,应转移____________个电子。
(Ⅱ)现有以下物质:(填序号)
① 铜 ② CO2 ③ 水 ④ CaCO3固体 ⑤ 蔗糖
以上物质中能导电的是______________,以上物质中属于电解质的是____________,以上物质中属于非电解质的________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.1mol/L的 H2SO4溶液980mL,欲用 98%、密度为1.84g/cm3的浓硫酸配制.
(1)所需的主要仪器除量筒、烧杯、玻璃棒外,还需要___________、______________。
(2)其实验操作步骤可分为以下几步:
A.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):_____________________
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视量筒刻度线,会导致所配溶液浓度会_________;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛仰视刻度线,所配溶液浓度会____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1: 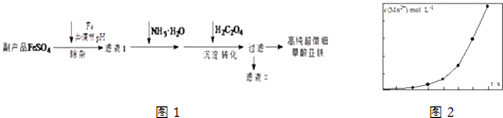
已知:①5Fe2++MnO ![]() +8H+═5Fe3++Mn2++4H2O
+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO ![]() +16H+═10CO2↑+2Mn2++8H2O
+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL 2molL﹣1的H2SO4溶解.
步骤2:用0.2000molL﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g Zn粉和5mL 2molL﹣1的H2SO4溶液,将Fe3+还原为Fe2+ .
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com