
【题目】铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入____________溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
(3)步骤③中判断滴定终点的方法是_____________________。
(4)通过计算确定铁钾矾的组成(写出计算过程)________________。
【答案】KSCN(或硫氰化钾) 1.1×10-5 滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复 25.00mLA溶液中:
n(SO42-)=0.4660g/233g mol-1=2×10-3mol
n(Fe3+)=0.1250molL-1×8.0×10-3L=1×10-3mol
根据电荷守恒:n(K+)=2×2×10-3mol-3×1×10-3mol=1×10-3mol
根据质量守恒,结晶水的物质的量:
[2.0120g×(25/100)-1×10-3mol×(39+56)molL-1-2×10-3mol×96gmol-1]/18gmol-1
=1.2×10-2mol
所以x∶y∶m∶n=1∶1∶2∶12,化学式为:KFe(SO4)212H2O
答:样品的组成为KFe(SO4)212H2O。
【解析】
(1)检验Fe3+可以用硫氰化钾溶液。
(2)根据BaSO4的Ksp=1.1×10-10和溶液中的c(SO42-)≤1.0×10-5 molL-1,计算c(Ba2+)。
(3)碘遇淀粉变蓝。
(4)根据步骤②确定SO42-的物质的量,根据步骤③确定Fe3+的物质的量,根据电荷守恒确定K+的物质的量,最后得到水的物质的量,得出铁钾矾的化学式。
(1)检验出A溶液中存在的Fe3+,加入KSCN(或硫氰化钾),出现血红色,故答案为KSCN(或硫氰酸钾);
(2)欲使溶液中c(SO42-)≤1.0×10-5molL-1,应保持溶液中c(Ba2+)≥ =1.1×10-5molL-1,故答案为1.1×10-5;
=1.1×10-5molL-1,故答案为1.1×10-5;
(3)以淀粉为指示剂,淀粉遇碘变蓝,当滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复,即达到滴定终点,故答案为当滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复;
(4)25.00mLA溶液中:n(SO42-)=0.4660g/233gmol-1=2×10-3mol
n(Fe3+)=0.1250molL-1×8.0×10-3L=1×10-3mol
根据电荷守恒:n(K+)=2×2×10-3mol-3×1×10-3mol=1×10-3mol
根据质量守恒,结晶水的物质的量:
[2.0120g×(25/100)-1×10-3mol×(39+56)molL-1-2×10-3mol×96gmol-1]÷18gmol-1=1.2×10-2mol,
所以x:y:m:n=1:1:2:12,化学式为:KFe(SO4)212H2O,
答:样品的组成为KFe(SO4)212H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】当用酸滴定碱时,下列操作中会使测定结果(碱的浓度)偏低的是
A.酸式滴定管滴至终点后,俯视读数
B.碱液移入锥形瓶后,加了10 mL蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准液润洗
D.酸式滴定管注入酸液后,尖嘴留有气泡即开始滴定,滴定终点时气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
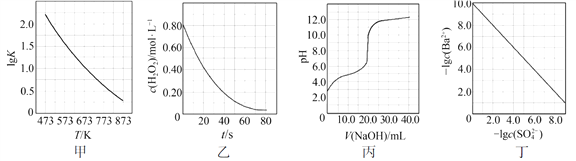
A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取无水氯化镁的装置图,下列有关表述正确的是
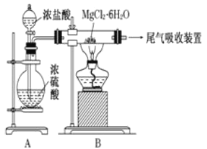
A.装置A中圆底烧瓶中可以换成固体MnO2
B.如果直接加热MgCl26H2O不能得到无水氯化镁,将得到Mg(OH)Cl或MgO
C.尾气吸收可以用浓硫酸作为吸收剂进行吸收
D.金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lg C8H18(辛烷)(相对分子质量:114)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D. C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是第二周期VA族元素,形成的N2H4、NH3等多种含氮化合物有着广泛的用途。回答下列问题:
(1)画出氮的核外电子排布图:___________。
(2)①肼(N2H4)又称联氨,常温下是一种可燃性液体,其燃烧热较大且产物对环境无污染,常用作火箭燃料。
已知:N2(g)+O2(g)=2NO(g) ΔH1;
2NO(g)+O2(g)=2NO2(g) ΔH2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
则反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=____(用含ΔH1、ΔH2、ΔH3的代数式表示)。
②肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是_____________;正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)某温度下,分别向三个体积为20 L的密闭容器中充入1 mol N2和2.6 mol H2分别保持恒温恒容、恒温恒压和绝热恒容,均发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。
2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N2的转化率(α)与反应时间(t)的关系如图所示。

①下列表示恒容时反应已达到平衡状态的是______ (填字母)。
A. 氨气的浓度不再变化 B. v(H2)=3v(N2)
C. ![]() 的值不再变化D. α(N2)=16.7%
的值不再变化D. α(N2)=16.7%
②图中代表反应在绝热恒容容器中进行的曲线是______(填“a”“b”或“c”)。
③b容器中,M点v正_____(填“大于”“小于”或“等于”)v逆。
④曲线a代表的条件下该反应的平衡常数K=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2B.Q1>Q2>QC.Q1>Q>Q2D.Q1=Q2>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径获得热量:
途径Ⅰ:C(s)+O2(g)═CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g) △H3<0 ③
2H2(g)+O2(g)═2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上____(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)途径Ⅱ在制水煤气的反应里,反应物所具有的总能量____生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要___能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是______
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(4)△H1、△H2、△H3、△H4的数学关系式是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达到平衡,平衡常数K=c(CO)·c(H2O)/ c(CO2)·c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值 B. 恒温恒容下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小 D. 该反应的化学方程式为CO2+H2 ![]() CO+H2O
CO+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com