
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。

【答案】Fe2++ 2H2O Fe(OH)2+2H+,加入稀硫酸,增大 H+浓度,平衡左移,抑制 Fe2+水解 FeS 溶解度更小 4Fe2++ O2 +4H+ = 4Fe3++ 2H2O Fe3++3SCN- Fe(SCN)3 实验ⅱ中加入少量KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 无明显现象 取褪色后的溶液滴加 KSCN 溶液 溶液变为红色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)配制0.5 mol·L-1FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,是因为亚铁离子水解显酸性,Fe2++ 2H2OFe(OH)2+2H+,加入稀硫酸,增大H+浓度,平衡左移,抑制Fe2+水解,故答案为:Fe2++ 2H2OFe(OH)2+2H+,加入稀硫酸,增大H+浓度,平衡左移,抑制Fe2+水解;
(2)Na2S溶液呈碱性,与FeSO4溶液反应有两种反应趋势,一种是发生双水解生成氢氧化亚铁,一种是发生复分解反应生成FeS沉淀,进一步研究证实,黑色沉淀的主要成分是FeS,不生成Fe(OH)2而生成FeS的可能原因是:FeS 溶解度更小。故答案为:FeS 溶解度更小;
(3)取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1KSCN溶液无现象,通入一段时间O2,溶液变为浅红色是通入的氧气氧化亚铁离子生成铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,铁离子结合SCN-形成血红色溶液,反应的离子方程式为:Fe3++3SCN- Fe(SCN)3,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;Fe3++3SCN- Fe(SCN)3;
(4)乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色,说明SCN-不能被O2氧化,故答案为:实验ⅱ中加入少量KSCN溶液无现象,通入一段时间O2,溶液变为浅红色;
实验验证假设c成立,SCN-被H2O2氧化的结论正确;重复实验ⅱ,取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1KSCN溶液无现象,通入一段时间O2,溶液变为浅红色,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去,可以验证氯化铁溶液不能氧化SCN-,过氧化氢能氧化SCN-,据此设计实验验证;实验设计和现象为:取褪色后溶液一份滴加FeCl3溶液,无明显现象,取褪色后的溶液滴加KSCN溶液,溶液变为红色,说明SCN- 被H2O2氧化,表中内容设计为:①无明显现象 ②取褪色后的溶液滴加KSCN溶液 ③溶液变为红色;
故答案为:
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加FeCl3 溶液 | ① 无明显现象 |
ii | ② 取褪色后的溶液滴加KSCN溶液 | ③ 溶液变为红色 |
(5)实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。


科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A.金属钠加入CuSO4溶液中:![]()
B.金属铝加入NaOH溶液中:![]()
C.铁粉加入FeC13溶液中:![]()
D.铜片插入浓HNO3溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
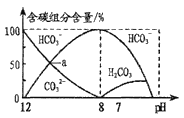
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填标号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是_________________。
(3)根据表中数据,计算待测盐酸溶液的浓度为________ mol·L-1。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为__________;加入的指示剂是____________。
(5)步骤②应使用________式滴定管。
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是________。(填标号)
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
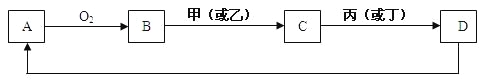
试回答:
(1) 写出B在工业生产中的一种用途___________________。
(2)写出B转化为C的可能的离子方程式____________________________。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理_______________。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为________mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式_______________________;若负极材料消耗18g,则电池转移的电子总数为_________。 (阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
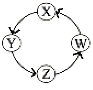
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
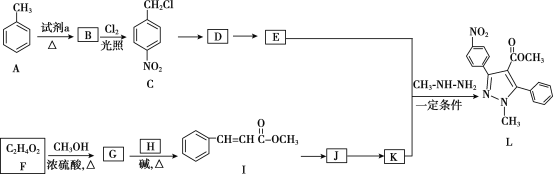
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成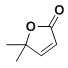 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二乙烯苯(![]() )可用作树脂、油漆及特种橡胶的原料下列说法正确的是
)可用作树脂、油漆及特种橡胶的原料下列说法正确的是
A.分子中所有原子可共平面B.一氯代物有4种(不考虑立体异构)
C.不能使酸性高锰酸钾溶液褪色D.1mol该分子最多可与2mol H2加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com