
| A、(Q1+Q2+Q3)kJ |
| B、0.5(Q1+Q2+Q3)kJ |
| C、(0.5Q1-1.5Q2+0.5Q3)kJ |
| D、(3Q1-Q2+Q3)kJ |
| 46g |
| 46g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、反应中共转移1.5mol 电子 |
| B、反应中共消耗锌48.75克 |
| C、气体A为H2和SO2的混合气 |
| D、气体A中H2与SO2的体积比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
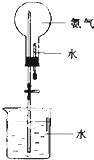 氨气的制取及性质探究(图中夹持装置均已略去).
氨气的制取及性质探究(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体密度保持不变 |
| B、v正(N2)=3 v逆(H2) |
| C、混合气体平均相对分子质量不变 |
| D、氨气的浓度是氮气浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、②③⑤ |
| C、①③⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1或3 | B、2或4 |
| C、2或3 | D、1或4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液不含SO42- |
| C、丙溶液不含Cl- |
| D、丁溶液含有Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com