
| A、蒸干AlCl3溶液可得纯净的无水氯化铝 |
| B、用碱式滴定管量取20.00mL酸性高锰酸钾溶液 |
| C、用pH试纸测定溶液的pH时预先要用蒸馏水湿润 |
| D、实验室配制SnCl2 溶液时,需要加入少量的盐酸 |


科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | MgCl2溶液 | 酚酞溶液 | NaCl溶液 |
| ③ | Na2O | Na2CO3 | NaHCO3 |
| ④ | KOH溶液 | Al | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | O | ||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
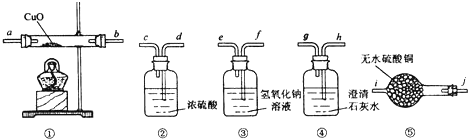
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| KOH |
| 室温 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com