
| A.[Cr(H2O)6] Cl3 | B.[Cr(H2O)5 Cl] Cl2·H2O |
| C.[Cr(H2O)4Cl2] Cl·2H2O | D.[Cr(H2O)3Cl3]·3H2O |
科目:高中化学 来源:不详 题型:单选题
| A.分子晶体中范德华力没有方向性和饱和性,所以分子晶体一般都采取密堆积,但要受到分子形状的影响。 |
| B.由于共价键的方向性和饱和性,原子晶体堆积的紧密程度大大降低。 |
| C.配位数就是配位键的数目 |
| D.离子晶体一般都是非等径球的密堆积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
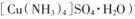 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下: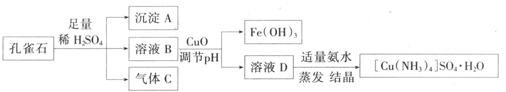
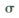 键和
键和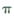 键的个数比为______
键的个数比为______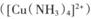 的配位键____________。
的配位键____________。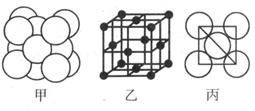
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O,O3,CCl4 | B.P2O5,CO2,H3PO4 |
| C.SO2,SiO2,CS2 | D.CCl4,(NH4)2S, H2O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N60是一种新型化合物 | B.N60和14N都是氮的同位素 |
| C.N60和N2是同素异形体 | D.N60和N2是同分异构体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若是离子化合物,则阳阴离子个数比肯定不等于1:1 |
| B.若由分子构成且有Y-Y键,则肯定是非极性分子 |
| C.若溶于水时有X-Y键的断裂,则肯定是强电解质 |
| D.若X、Y原子间的共价键键能大,则熔、沸点肯定高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com