
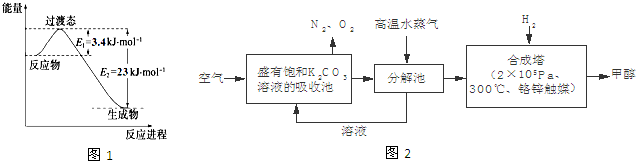
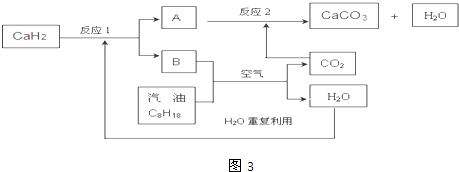
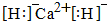 ;
;| 19.6mol |
| 80% |
| 6.72L |
| 22.4L/mol |
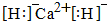 故答案为:
故答案为: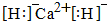 ;
;

科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
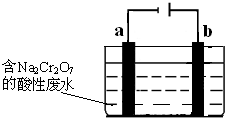
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是黏土、石灰石、石膏的混合物 |
| B、水泥、沙子和水的混合物成为水泥沙浆 |
| C、水泥、沙子和碎石的混合物称为混凝土 |
| D、水泥和水混合搅拌后很容易凝固变硬具有水硬性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的分子式是C6H12O6,是一种多羟基醛,因而具有醛和醇的性质 |
| B、葡萄糖是碳水化合物,因为它的分子(C6H12O6)是由6个碳原子和6个水分子组成的 |
| C、葡萄糖是提供给人体能量的营养物质,它在人体中主要发生氧化反应 |
| D、葡萄糖是单糖,它和果糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 | |
| A | 向硅酸钠溶液中滴加1滴酚酞,再逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| C | 常温下,向浓硫酸中投入铝片 | 铝片不溶解 | 常温下,铝不与浓硫酸反应 |
| D | 向某无色溶液中先滴加氯水,再加少量CCl4,振荡,静置 | 溶液分层,下层为橙红色 | 溶液中含有Br- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com