
【题目】化合物H是一种有机材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
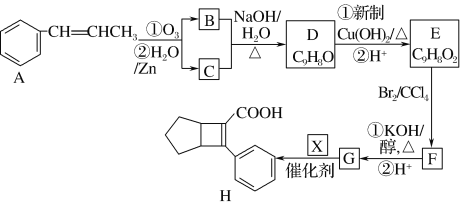
已知①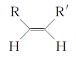
![]() RCHO+R′CHO
RCHO+R′CHO
②RCHO+R′CH2CHO![]()
![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_______,C的同系物中相对分子质量最小的结构简式为_______。
(2)由F生成G的第①步反应类型为_______。
(3)X的结构简式为_______。
(4)写出D生成E的第①步反应的化学方程式________
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学环境的氢,且峰面积之比为6∶2∶1∶1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物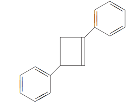 的合成线路,其他无机试剂任选________。
的合成线路,其他无机试剂任选________。
【答案】苯甲醛 HCHO 消去反应 
 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
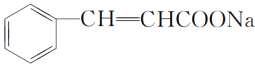 +Cu2O↓+3H2O 4
+Cu2O↓+3H2O 4  、
、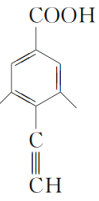 、
、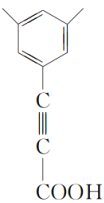 、
、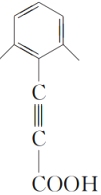 (任写一种)
(任写一种) 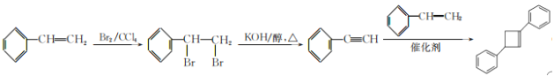
【解析】
根据提供信息①,可知A发生信息①反应的产物为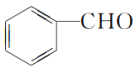 、CH3CHO,故芳香族化合物B的名称为苯甲醛;根据信息②,可知B和C发生信息②反应的产物D为
、CH3CHO,故芳香族化合物B的名称为苯甲醛;根据信息②,可知B和C发生信息②反应的产物D为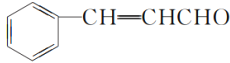 ,
,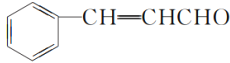 与新制氢氧化铜反应后酸化,-CHO转化为-COOH,E为
与新制氢氧化铜反应后酸化,-CHO转化为-COOH,E为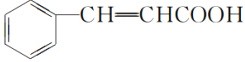 ,E与Br2发生加成反应得到的F为
,E与Br2发生加成反应得到的F为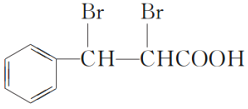 ,根据F→G的第①步反应条件,可知该反应为消去反应;F发生消去反应后酸化得到G为
,根据F→G的第①步反应条件,可知该反应为消去反应;F发生消去反应后酸化得到G为 ,根据G+X→H,结合信息③可以推断X为
,根据G+X→H,结合信息③可以推断X为 ,据此分析解答。
,据此分析解答。
(1)根据提供信息①,可知A发生信息①反应的产物为 、CH3CHO,故芳香族化合物B的名称为苯甲醛,CH3CHO的同系物中相对分子质量最小的为HCHO;
、CH3CHO,故芳香族化合物B的名称为苯甲醛,CH3CHO的同系物中相对分子质量最小的为HCHO;
(2)根据信息②,可知B和C发生信息②反应的产物D为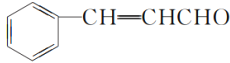 ,
,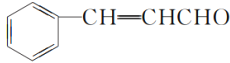 与新制氢氧化铜反应后酸化,-CHO转化为-COOH,E为
与新制氢氧化铜反应后酸化,-CHO转化为-COOH,E为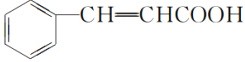 ,E与Br2发生加成反应得到的F为
,E与Br2发生加成反应得到的F为 ,根据F→G的第①步反应条件,可知该反应为消去反应。
,根据F→G的第①步反应条件,可知该反应为消去反应。
(3)F发生消去反应后酸化得到G为 ,根据G+X→H,结合信息③可以推断X为
,根据G+X→H,结合信息③可以推断X为 ;
;
(4)D生成E的第①步反应为 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
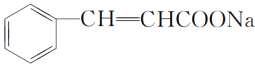 +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(5)G为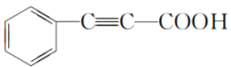 ,与乙醇发生酯化反应生成的化合物Y为
,与乙醇发生酯化反应生成的化合物Y为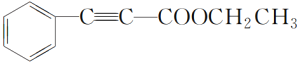 ,根据①能与饱和碳酸氢钠反应生成二氧化碳,可知含有羧基。根据②核磁共振氢谱显示有4种不同化学环境的氢,且峰面积之比为6∶2∶1∶1,则符合条件的同分异构体有
,根据①能与饱和碳酸氢钠反应生成二氧化碳,可知含有羧基。根据②核磁共振氢谱显示有4种不同化学环境的氢,且峰面积之比为6∶2∶1∶1,则符合条件的同分异构体有 、
、 、
、 、
、 。
。
(6)![]() 与溴的四氯化碳溶液发生加成反应生成
与溴的四氯化碳溶液发生加成反应生成![]() ,
,![]() 在加热条件下与氢氧化钾醇溶液发生消去反应生成
在加热条件下与氢氧化钾醇溶液发生消去反应生成![]() ,在催化剂作用下与
,在催化剂作用下与![]() 发生加成反应生成
发生加成反应生成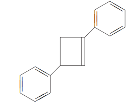 ,合成线路
,合成线路 。
。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
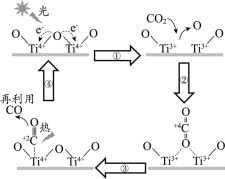
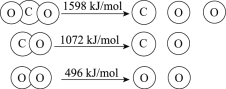
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量a—非兰烃,其相对分子质量为 136。根据如下转化,回答相关问题。
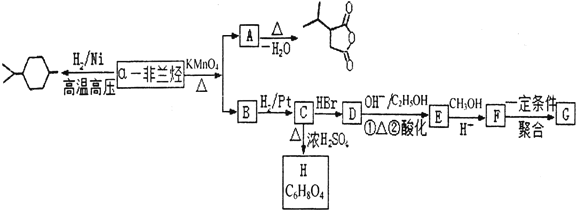
已知:Ⅰ. ![]()
![]()
![]() +RCOOH
+RCOOH
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ.2CH3COOH![]()
![]()
(1)a—非兰烃的结构简式为______。
(2)B 中含有的官能团名称为______,C→D 的反应类型为______。
(3)C→H 的反应方程式为______。
(4)写出符合下列条件 A 的同分异构体______(写三种即可)。
①含有 4 个—CH3②1mol 此同分异构体在碱性条件下水解需 2mol NaOH。
(5)以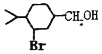 为原料合成
为原料合成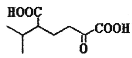 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
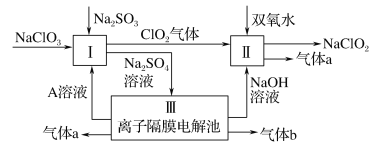
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____。
(3)Ⅲ中离子隔膜电解池的装置如下:
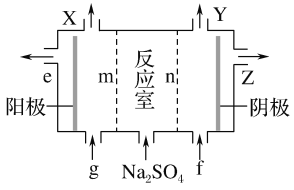
①A的化学式是________,A在____口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的![]() .甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是( )
.甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是( )

A.离子半径:r(Y)>r(Z)>r(W)
B.N与M的反应达平衡时,加热逆向移动
C.含W元素的盐溶液不可能显碱性
D.Z与X、Y、W形成的化合物中,只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )
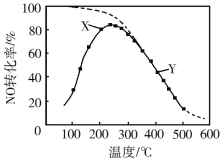
A.反应2NO(g)+O2(g)=2NO2(g)的ΔH<0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25.00 mL氢氧化钠溶液中逐滴加入0.2000 mol·L-1醋酸溶液,滴定曲线如图所示。
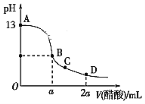
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________。
(2)该氢氧化钠溶液的物质的量浓度为_________mol·L-1。
(3)设在B点时酸碱恰好中和,则a=____________。
(4)若所加入的酸为0.2000 mol·L-1的盐酸,则D点时溶液的c(H+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com