
| A. | 正反应生成的NH3速率和逆反应生成N2的速率相等 | |
| B. | 反应器中压强不随时间变化而变化 | |
| C. | 1molN≡N键断裂的同时,有6molN-H键断裂 | |
| D. | 混合气体平均分子量保持不变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、化学平衡状态时,正反应生成的NH3速率和逆反应生成N2的速率的2倍,故A错误;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故B正确;
C、1molN≡N键断裂,等效于6molN-H键形成的同时,有6molN-H键断裂,达平衡状态,故C正确;
D、混合气体平均分子量保持不变,说明物质的量不变反应达平衡状态,故D正确;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | C3H6O | B. | C3H8O3 | C. | C3H8O2 | D. | C3H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3COCH3 | B. | CH3CH2CHO | C. | CH2=CH-CH2OH | D. | CH2=CH-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ③CH3CH2Br④
③CH3CH2Br④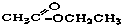 ⑤
⑤ ⑥
⑥
 ⑧
⑧ ⑨
⑨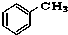 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3(a+b)}{b-a}$ | B. | $\frac{16(b+a)}{b-a}$ | C. | $\frac{8(b-a)}{b+a}$ | D. | $\frac{16(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 0.5mol | NA | |
| B | 53g | 0.5mol | |
| C | 53g | NA | |
| D | 11.2L | 0.5mol |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F、O、N非金属性依次减弱,HF、H2O、NH3沸点依次降低 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐增强 | |
| C. | Al3+、Mg2+、Na+的离子半径依次增大 | |
| D. | HF、HCl、HBr、HI稳定性依次减弱,还原性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com