
【题目】“胃舒平”的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。下列叙述中错误的是( )
A. 镁元素基态原子的核外电子排布式是:1s22s22p63s2
B. 铝元素原子核外共有5种不同运动状态的电子
C. 钠元素离子半径比铝离子半径大
D. 金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑
【答案】B
【解析】试题分析:A.镁元素基态原子的核外电子排布式是:1s22s22p63s2,A正确;B.铝元素原子核外共有13种不同运动状态的电子,B错误;C.钠元素离子半径比铝离子半径大,C正确;D.金属铝与钠的最高价氧化物的水化物溶液发生反应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑,D正确,答案选B。
考点:考查核外电子排布、微粒半径等有关判断
【题型】单选题
【结束】
17
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
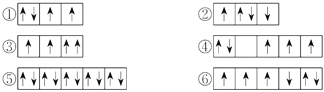
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
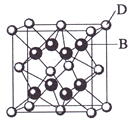
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A原子中只含1个电子;B原子的3p轨道上得到1个电子后不容纳外来电子;C原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四电子层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)按要求书写下列图式。
①B原子的结构示意图:________;
②C原子的电子排布图:________;
③D原子的核外电子排布式:________;
④B离子的电子式:________。
(2)写出由A、B、C、D中的三种元素组成的化合物的化学式:___________(至少写出5种)。
(3)写出由上述元素组成的物质制得A的单质的化学方程式:___________(至少写出2个)。
(4)写出E的元素符号:________,要证明太阳光中含有E元素,可采用的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应:xR2++Cl2=yR3++zCl-的说法中正确的是( )
A.x=y,R2+得到电子
B.x=2, Cl2作氧化剂
C.y=z,R3+是还原产物
D.x=z, Cl-是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素:①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述________(填写编号,下同)决定;对气体物质而言,它主要由上述____________决定。
(2)标准状况下,体积为11.2 L的CO2的质量________g,其所含原子的总数是________个。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,仪器使用不正确的是( )
A. 熄灭酒精灯用灯帽盖灭
B. 加热烧杯时垫石棉网
C. 在量筒中稀释浓硫酸
D. 制取乙烯时,温度计插入混合液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。

①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。

①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com