
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
分析 A、某温度下,纯水的pH=6,则水的离子积Kw=10-12;
B、氯化铝溶液体积不明确;
C、锌能与稀硫酸反应;
D、C3H6和C4H8的最简式均为CH2.
解答 解:A、某温度下,纯水的pH=6,则水的离子积Kw=10-12,pH=10的氨水中,氢离子浓度c(H+)=10-10mol/L,则c(OH-)=10-2mol/L,则1L氨水中含有的氢氧根的物质的量为0.01mol,个数为0.01NA个,故A正确;
B、氯化铝溶液体积不明确,故和氢氧化钠溶液反应后所得产物中Al的个数无法计算,故B错误;
C、锌既能与浓硫酸反应又能与稀硫酸反应,故生成的标准状况下的气体2.24L即0.1mol气体中既有二氧化硫又有氢气.若0.1mol气体全部是二氧化硫,则消耗硫酸为0.2mol;若0.1mol气体全部是氢气,则消耗硫酸0.1mol.而现在0.1mol气体中既有二氧化硫又有氢气,故参加反应的硫酸在0.1mol到0.2mol之间,故C错误;
D、C3H6和C4H8的最简式均为CH2,故42g混合物中含有的CH2的物质的量为3mol,而CH2中含2条共价键,故含6mol共价键即6NA条,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | ll | C. | 13 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
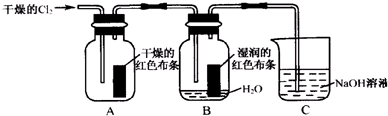
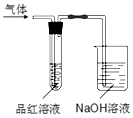 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
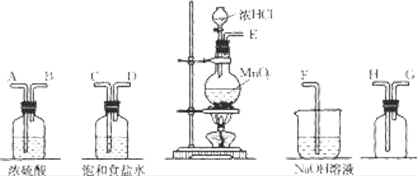
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
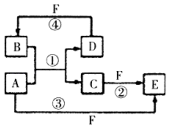 (1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题:
(1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题: ;
; ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成蓝色 | Cl2+2I-=I2+2Cl-(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl(用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
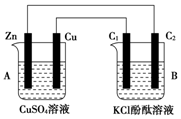 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com