
有某可逆反应aA(g)+bB(g) cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H<0时,y轴表示达到平衡时A的浓度

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为______________________________________________。
(3)丁组实验发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
| 选项 | 氧化物 | 环境问题 | 主要来源 |
| A | CO | 煤气中毒 | 含碳燃料的不完全燃烧 |
| B | SO2 | 光化学烟雾 | 汽车尾气的排放 |
| C | NO2 | 温室效应 | 工厂废气的排放 |
| D | CO2 | 酸雨 | 化石燃料的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为 V L的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g) 2Z(g) ΔH<0
2Z(g) ΔH<0
(1)该反应的化学平衡常数表达式为______________。
(2)若升高温度,化学反应速率________,Z的浓度________,化学平衡常数K________(均填“增大”、“减小”或“不变”)。
(3)下图中Ⅰ、Ⅱ表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线:
由图Ⅰ判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表示);
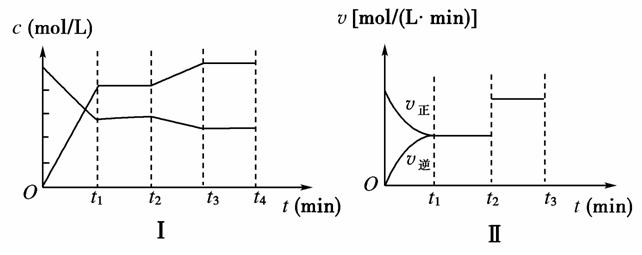
由图Ⅱ判断,t2 min到t3 min的曲线变化的原因可能是________(填字母)。
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中A(g)+3B(g)  2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是( )
2C(g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中不正确的是( )
A.混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据
B.容器中混合气体的平均相对分子质量增大
C.正反应速率和逆反应速率都变小,C的百分含量增加
D.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图。下列叙述与示意图不相符的是( )
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I以后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一种反应物在平衡态I和平衡态II时浓度不相等。

查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应mM(气)  nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
A、平衡正向移动; B、物质M的转化率增大; C、n > m D、物质N的质量分数减少
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是 )。
A.2SO2+O2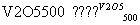 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2g)+ O2g)===H2Ol) ΔH=-285.8 kJ·mol-1
O2g)===H2Ol) ΔH=-285.8 kJ·mol-1
C.2H2g)+O2g)===2H2Ol) ΔH=-571.6 kJ
D.Cs)+O2g)===CO2g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)旋转喷雾干燥法是去除燃煤烟气中二氧化硫的方法之一,工艺流程如下图所示,写出雾化器中发生反应的化学方程式:________________________________________________。

(2)已知NaHSO3溶液显弱酸性,其原因用离子方程式表示为____________。
(3)请按照浓度由大到小的顺序排列0.1 mol·L-1 Na2SO3 溶液中的离子________。Na2SO3溶液放置于空气中一段时间后,溶液的pH________(填“增大”、“减小”或“不变”)。
(4)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明________(填字母)。
A.该Na2S2O3溶液中水电离的c(OH-)=10-8 mol·L-1
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3能发生水解,其离子方程式为S2O +2H2O===H2S2O3+2OH-
+2H2O===H2S2O3+2OH-
实验②说明Na2S2O3具有________性。写出发生反应的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com