



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、用溶解、过滤的方法分离CaCl2和NaCl的固体混合物 |
| B、用BaCl2除去NaOH溶液中混有的少量Na2SO4 |
| C、用酒精把碘水中的碘萃取出来 |
| D、用澄清石灰水检验CO中是否含有CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 序号 | 碳粉的质量/g | 氮气的物质的量/mol | 二氧化硅的质量/g | 二氧化硅的形状 | 反应温度/℃ | 达到平衡所用的时间/s | 平衡时氮化硅的质量/g |
| 1 | 7.2 | 3.0 | 12.0 | 大颗粒 | 1500 | 300 | m1 |
| 2 | 7.2 | 3.0 | 12.0 | 大颗粒 | 1550 | 200 | m2 |
| 3 | 7.2 | 3.0 | 12.0 | 小颗粒 | 1550 | 120 | m3 |
| 4 | 7.2 | 3.0 | 12.0 | 小颗粒 | 1600 | 80 | 6.3 |
| 5 | 7.2 | 3.0 | 12.0 | 粉末 | 1550 | t1 | 7.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.查看答案和解析>>
科目:高中化学 来源: 题型:
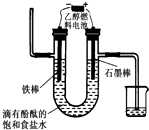
 如图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出).
如图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出).查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示已知:
如图所示已知:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PH3分子稳定性低于NH3分子,因为N-H键键能高 |
| B、PH3分子中是P是sp3杂化 |
| C、PH3沸点低于NH3沸点,因为P-H键键能低 |
| D、PH3分子呈三角锥形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com