
【题目】工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )
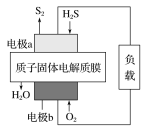
A.电极a为电池的负极
B.电极b上的电极反应式为O2+4H++4e-===2H2O
C.若电路中通过2 mol电子,则电池内部释放632 kJ热能
D.若有17 g H2S参与反应,则会有1 mol H+经质子膜进入正极区
【答案】C
【解析】
根据2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,得出负极H2S失电子发生氧化反应 正极O2得电子发生还原反应,据此分析解
A.由2H2S(g)+O2(g)=S2(s)+2H2O(l) ΔH=-632 kJ·mol-1,得出负极H2S失电子发生氧化反应,则a 为电池的负极,故A正确;
B.正极O2得电子发生还原反应,所以电极 b上发生的电极反应为 O2+4H++4e-=2H2O,故B正确;
C.电路中每流过2mol电子,则消耗0.5mol 氧气,但该装置将化学能转化为电能,所以电池内部几乎不放出能量,故C错误;
D.每17g即0.5molH2S参与反应,则消耗 0.25mol氧气,则根据 O2+4H++4e-=2H2O,所以有1moH+经 质子膜进入正极区,故D正确;
故选C 。


科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3< HClO<HF
B.向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO) >c(OH-)
C.根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D.若将CO2通入0.lmol/LNa2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越______。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=_________(可用分数表示)。能说明该反应达到化学平衡状态的是_______(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是_________(选填序号)。
a.  b.
b.  c.
c. 
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a______b(填“>”“=”或“<”,下同),Q1_____92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。
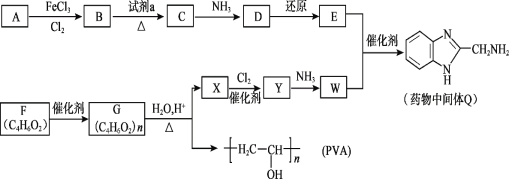
已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________
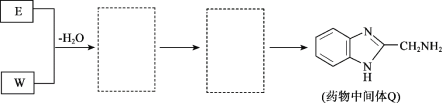
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是(已知Ksp(AgCl)=4.0×10-10,Ksp(AgBr)=4.9×10-13,Ksp(Ag2CrO4)=2.0×10-12)
A.0.lmol·L-1 NH4HS溶液中有:c(NH4+)+c(NH3·H2O)>c(HS-)+c(S2-)
B.将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀质量大于AgBr沉淀
C.向浓度均为1×10-3mol/L的KCl和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
D.常温下,pH=4.75、浓度均为0.l mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的离子方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该反应的化学方程式___。配制FeCl3溶液和FeCl2溶液都应保持___(填“酸性”“碱性”或“中性”),原因是___。配制FeCl2溶液时还应加入少量铁屑,原因是___。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3- ②I3-+2S2O32-=3I-+S2O62-
反应①中的还原产物为___。现取10.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液12.50mL,此溶液中Cu2+的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2![]() 在空气中存在下列平衡:2NO(g)+O2(g)
在空气中存在下列平衡:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
2SO3(g) ΔH=-196.6 kJ·mol-1。SO2通常在NO2的存在下,进一步被氧化生成SO3(g)。写出NO2和SO2反应生成NO(g)和SO3(g)的热化学方程式为________。
(2)提高2SO2(g)+O2(g)![]() 2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3(g)反应中SO2的转化率,是减少SO2排放的有效措施。
①温度为T℃时,在2 L的密闭容器中加入2.0 mol ![]() 和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的
和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的![]() 。该反应的平衡常数为_____。
。该反应的平衡常数为_____。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是_____。
A.在其他条件不变时,减少容器的体积
B.在其他条件不变时,改用高效催化剂
C.在其他条件不变时,升高体系温度
D.1.0mol温度和容器体积不变,充入1.0 mol氦气![]()
E.温度和容器体积不变,充入1.0 mol O2
(3)利用如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为______;若通入的NO体积为4.48 L(标况下),则理论上另一电极通入SO2的物质的量应为_______。
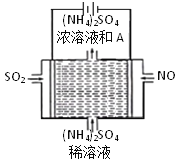
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(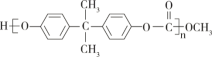 )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com