
���� ��1��Cu��Ũ���ᷴӦ����NO2����ϡ���ᷴӦ����NO��CuO�����ᷴӦ��������ͭ��H2O�����������������ˮ��Ӧ����HNO3����������ķ�Ӧ�������õ��ĵ����������������ɵ�������õ��ĵ�����������ת�Ƶ����غ㡢Nԭ���غ����NO��NO2�����ʵ������ٸ���V=nVm������������
��2�����ݵ�ʧ�����غ㣬n��Cu��=2n��O2����
��3����Ӧ����Һ�м���NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�����������غ�n��NaNO3��=n��NaOH�������ݵ�ԭ���غ��֪n��HNO3��=n��NaNO3��+n��NO2+NO����������V=$\frac{n}{V}$�������Ҫ����������Һ�������
��� �⣺��1��n��NO+NO2��=$\frac{8.96L}{22.4L/mol}$=0.4mol��n��O2��=$\frac{4.48L}{22.4L/mol}$=0.2mol��Cu��Ũ���ᷴӦ����NO2����ϡ���ᷴӦ����NO��CuO�����ᷴӦ��������ͭ��H2O�����������������ˮ��Ӧ����HNO3����������ķ�Ӧ�������õ��ĵ����������������ɵ�������õ��ĵ�������
��NO��NO2�����ʵ����ֱ���xmol��ymol��
����ת�Ƶ����غ㡢Nԭ���غ�ã�
$\left\{\begin{array}{l}{x+y=0.4}\\{3x+y=0.2��4}\end{array}\right.$��
$\left\{\begin{array}{l}{x=0.2}\\{y=0.2}\end{array}\right.$��
����V=nVm�ö�������ֱ�=0.2mol��22.4L/mol=4.48L��
�ʴ�Ϊ��4.48��4.48��
��2�����ݵ�ʧ�����غ㣬n��Cu��=2n��O2��=2��0.2mol=0.4mol��m��Cu��=64g/mol��0.4mol=25.6g��
�ʴ�Ϊ��25.6��
��3����Ӧ����Һ�м���NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ʱ��Һ������ΪNaNO3�����������غ�n��NaNO3��=n��NaOH�������ݵ�ԭ���غ��֪n��HNO3��=n��NaNO3��+n��NO2+NO����n��NaNO3��=n��HNO3��-n��NO2+NO��=11mol/L��0.2L-0.4mol=1.8mol������Naԭ���غ��n��NaNO3��=n��NaOH��=1.8mol��V��NaOH��=$\frac{n}{V}$=$\frac{1.8mol}{4mol/L}$=0.45L��
�ʴ�Ϊ��0.45��
���� ���⿼��������ԭ��Ӧ�йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷ����������֮��Ĺ�ϵ�ǽⱾ��ؼ���ע��ԭ���غ㡢ת�Ƶ����غ��Ӧ�ã���Ŀ�Ѷ��еȣ�


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼΪij�����������Լ�ƿ��ǩ�ϵIJ������ݣ�ͨ������ش�
��ͼΪij�����������Լ�ƿ��ǩ�ϵIJ������ݣ�ͨ������ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ�ͻ��������г�����ѹ����װ����Ҫ������������ | |
| B�� | ���δ������Ĵ�����Ⱦ������ж�������������ȣ�Ӧ�û������ | |
| C�� | �¹ʴ����е�����ˮȫ������Ӧ�����У������˶��ܱߺ������Ⱦ | |
| D�� | һ�����һ�������ˮƽ���þ���ϩ�IJ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N5+�к���36������ | B�� | C60��Ħ������Ϊ720 | ||
| C�� | H2��H3��Ϊͬλ�� | D�� | O2��O4����ͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۷е㣺X2Y��X2R | |
| B�� | WY2����Ӧ�����������κ��ᷴӦ | |
| C�� | Z��Y�γɵĻ����ﲻ����Ϊ���²��� | |
| D�� | ԭ�Ӱ뾶��X��Y��Z��R��W��˳�����μ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
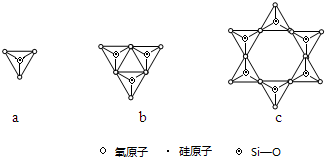
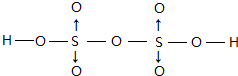 ����λ����ע������
����λ����ע������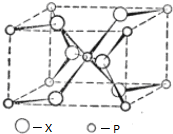
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Po�ľ���ѻ�ģ���Ǽ������ѻ�������λ����8 | |
| B�� | ԭ�Ӿ�����ԭ���Թ��ۼ���ϣ����м��ܴ��۵�ߣ�Ӳ�ȴ���ص� | |
| C�� | �Ȼ��ƾ����У�ÿ��������ƽ������4�������Ӻ�4�������� | |
| D�� | �ڱ������У�ÿһ��ˮ������Χ��4��ˮ���ӽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ���о�����Ԫ���⻯��ķе�仯���ɵ�ͼ������c���Ա�����ڢ�A��Ԫ���⻯��ķе�仯���ɣ���λͬѧ��ij����Ԫ���⻯��ķе�ı仯���ƻ�������������--����a������b������Ϊ��ȷ����b���a����b������������A����ʾ���⻯����ˮ����е��������ˮ���Ӽ�����������������Ԫ���������⻯��ķе㲻�����ˮ��
��ͼ���о�����Ԫ���⻯��ķе�仯���ɵ�ͼ������c���Ա�����ڢ�A��Ԫ���⻯��ķе�仯���ɣ���λͬѧ��ij����Ԫ���⻯��ķе�ı仯���ƻ�������������--����a������b������Ϊ��ȷ����b���a����b������������A����ʾ���⻯����ˮ����е��������ˮ���Ӽ�����������������Ԫ���������⻯��ķе㲻�����ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com